1、选择题 下列物质属于盐类,且其水溶液呈中性的是
A.CCl4
B.Na2SO4
C.Na2CO3
D.AlCl3
参考答案:B
本题解析:四氯化碳不是盐。硫酸钠是盐,不水解,水溶液显中性。碳酸钠是盐,溶于水CO32-水解,水溶液显碱性。氯化铝是盐,Al3+水解,水溶液显酸性,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对盐类概念以及盐类水解的熟悉了解程度,旨在巩固学生的基础,提高学生的应试能力。
本题难度:简单
2、选择题 常温下,稀释0.1 mol·L-1Na2CO3溶液,下图中的纵坐标可以表示?(?)
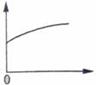
A.CO32—水解的平衡常数
B.溶液的pH
C.溶液中HCO3—离子数
D.溶液中c(CO32—)
参考答案:C
本题解析:A项:CO32—水解的平衡常数只与温度有关,故错;B项:稀释会使PH变小,故错;D项:稀释会使c(CO32—)变小,故错。
故选C。
点评:本题考查的是水解的平衡常数和盐类水解的影响因素,考查学生对基础知识的掌握程度,题目难度适中。
本题难度:一般
3、选择题 物质的量浓度相同的下列溶液:①Na2CO3?②NaHCO3?③H2CO3?
④(NH4)2CO3?⑤NH4HCO3,按c(CO32-)由小到大排列顺序正确的是
A.⑤<④<③<②<①
B.③<⑤<②<④<①
C.③<②<⑤<④<①
D.③<⑤<④<②<①
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图
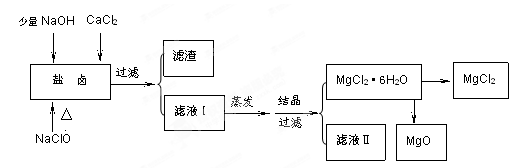
(1)滤液Ⅱ中所含主要的杂质离子是?(写离子符号)。
(2) 加入NaClO的作用是?。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。
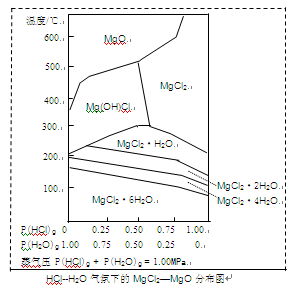
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式?;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
?;若要得到无水MgCl2须采取的措施是?。
参考答案:(1)Na+
(2)将Fe2+ 氧化为 Fe3+ ,并形成Fe(OH)3 被除去
(3)① Mg(OH)Cl  ?MgO? + HCl↑
?MgO? + HCl↑
②P(HCl)小,加热时Mg2+?会发生水解
通入HCl,增大P(HCl,抑制 Mg2+水解
本题解析:
(1)滤渣的成分是Fe(OH)3;滤液Ⅱ中所含的主要杂质离子是Na+。 (2)加入NaClO还能起到的作用是氧化Fe2+使它变成Fe(OH)3沉淀而除去。 (3)直接将MgCl2·6H2O加强热能得到MgO,反应的化学方程式是MgCl2·6H2O MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中为抑制上述反应,所需要的化学试剂是HCl气体。
MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中为抑制上述反应,所需要的化学试剂是HCl气体。
① Mg(OH)Cl  ?MgO? + HCl↑②P(HCl)小,加热时Mg2+?会发生水解;通入HCl,增大P(HCl,抑制 Mg2+水解。
?MgO? + HCl↑②P(HCl)小,加热时Mg2+?会发生水解;通入HCl,增大P(HCl,抑制 Mg2+水解。
本题难度:一般
5、填空题 回答下列有关Na2S溶液的问题。
(1)Na2S溶液盛装在带橡胶塞的试剂瓶中,仔细闻有臭鸡蛋气味,请用离子方程式解释:
?,?。
(2)将Na2S溶液加入AlCl3溶液中,有白色沉淀和臭鸡蛋气味的气体生成,发生的离子反应为:
?。
(3)将Na2S溶液加入AgCl的浊液中,生成的黑色沉淀是?(写化学式)。
参考答案:(1)S 2-+ H2O HS- +OH-,? HS-+ H2O
HS- +OH-,? HS-+ H2O H2S +OH-
H2S +OH-
(2)2Al 3+ + 3S 2-+6 H2O = 3H2S↑+ 2Al(OH)3↓
(3)Ag2S
本题解析:(1)多元弱酸根离子要分步水解,以第一步为主
(2)Al 3+与S 2-水解生成Al(OH)3沉淀
(3)S 2-与 结合成Ag2S
结合成Ag2S
本题难度:一般