1、选择题 分子式为C5H11Cl,含有三个甲基的有机物有
A.2种
B.3种
C.4种
D.8种
参考答案:B
本题解析:考查同分异构体的判断。该有机物可以看作是戊烷中的1个氢原子被氯原子取代后的产物,戊烷有正戊烷、异戊烷和新戊烷三种,所以其中含有三个甲基的有机物有3种,答案选B。
本题难度:困难
2、选择题 把一定量的铁和硫化亚铁的混合物与100mL?2mol/L的硫酸充分反应后,固体完全溶解,同时生成气体Y?3.36L(在标准状况下).将反应后的溶液稀释到1L,测得溶液的pH=1,则下列叙述一定正确的是
A.气体Y是H2
B.气体Y中H2和H2S的体积比为1:2
C.反应中共消耗混合物10g
D.反应中转移电子小于0.3?mol
参考答案:D
本题解析:分析:A.铁与硫酸反应生成硫酸亚铁与氢气,硫化亚铁与硫酸反应生成硫酸亚铁与硫化氢;
B.由于H2SO4+Fe=FeSO4+H2↑,H2SO4+FeS=FeSO4+H2S↑,根据方程式可知,由混合气体的体积可以计算铁和硫化亚铁的混合物总的物质的量,但二者物质的量关系不确定,不能计算H2和H2S的体积之比;
C.由于H2SO4+Fe=FeSO4+H2↑,H2SO4+FeS=FeSO4+H2S↑,根据方程式可知,由混合气体的体积可以计算铁和硫化亚铁的混合物总的物质的量,但二者物质的量关系不确定,不能确定二者的质量之和;
D.H2SO4+Fe=FeSO4+H2↑属于氧化还原反应,假定3.36L全为氢气,转移电子最多,计算氢气的物质的量,结合化合价计算转移电子物质的量,据此判断.
解答:A.发生反应H2SO4+Fe=FeSO4+H2↑,H2SO4+FeS=FeSO4+H2S↑,生成的气体应该是氢气、硫化氢的混合气体,故A错误;
B.由于H2SO4+Fe=FeSO4+H2↑,H2SO4+FeS=FeSO4+H2S↑,根据方程式可知,由混合气体的体积可以计算铁和硫化亚铁的混合物总的物质的量,但二者物质的量关系不确定,不能计算H2和H2S的体积之比,故B错误;
C.由于H2SO4+Fe=FeSO4+H2↑,H2SO4+FeS=FeSO4+H2S↑,根据方程式可知,由混合气体的体积可以计算铁和硫化亚铁的混合物总的物质的量,二者摩尔质量不同,由于二者物质的量关系不确定,不能确定二者的质量之和,故C错误;
D.H2SO4+Fe=FeSO4+H2↑属于氧化还原反应,假定3.36L全为氢气,转移电子最多,氢气的物质的量为 =0.15mol,故转移电子为0.15mol×2=0.3mol,由于3.36L为氢气、硫化氢的混合气体,故反应中转移电子小于0.3mol,故D正确;
=0.15mol,故转移电子为0.15mol×2=0.3mol,由于3.36L为氢气、硫化氢的混合气体,故反应中转移电子小于0.3mol,故D正确;
故选D.
点评:本题考查混合物的有关计算,难度不大,根据发生反应进行解答,D选项注意利用极限法进行判断.
本题难度:简单
3、选择题 由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论中正确的是
A.混合物中一定含有铝
B.混合物中一定含有铁
C.该混合物一定是由铁和镁组成的
D.混合物中一定不含有铁
参考答案:B
本题解析:分析:根据n= 计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
解答:标准状况下,2.8L氢气的物质的量= =0.125mol,
=0.125mol,
根据电子转移守恒可知,6g混合金属提供电子的物质的量为0.125mol×2=0.25mol,
故提供1mol电子需要混合金属的平均质量为6g× =24g,
=24g,
镁与盐酸反应表现+2价,提供1mol电子需要Mg的质量为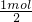 ×24g/mol=12g,
×24g/mol=12g,
铝与盐酸反应表现+3价,提供1mol电子需要Al的质量为 ×27g/mol=9g,
×27g/mol=9g,
铁与盐酸反应表现+2价,提供1mol电子需要Fe的质量为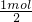 ×56g/mol=28g,
×56g/mol=28g,
Fe提供1mol电子的质量大于24g,Mg、Al提供1mol电子的质量小于24g,故一定含有Fe,Mg、Al至少含有一种,
故选B.
点评:本题考查混合物的有关计算,难度不大,注意利用平均值法与极限法的利用.
本题难度:困难
4、选择题 实验室利用氧化还原反应才可以制取的气体是
①HCl? ②SO2? ③O2? ④Cl2? ⑤CO2 ⑥NO? ⑦NH3? ⑧H2S.
A.③④⑤⑥
B.②⑤⑥
C.③④⑤
D.以上都不对
参考答案:D
本题解析:分析:有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,利用氧化还原反应才可以制取的气体,说明发生的化学反应中有电子转移.
解答:①实验室用浓硫酸和氯化钠制取氯化氢气体,该反应中各元素的化合价都不变,所以不是氧化还原反应,故不选;
②实验室用浓硫酸和亚硫酸钠制取二氧化硫,该反应中各元素的化合价都不变,所以不是氧化还原反应,故不选;
③实验室用分解双氧水或氯酸钾或高锰酸钾制取氧气,该反应中有电子转移,所以是氧化还原反应,故选;
④实验室用浓盐酸和二氧化锰加热制取氯气,该反应中有电子转移,所以是氧化还原反应,故选;
⑤实验室用稀盐酸和碳酸钙制取二氧化碳,该反应中各元素的化合价都不变,所以不是氧化还原反应,故不选;
⑥实验室用铜和稀硝酸反应制取一氧化氮,该反应中有电子转移,所以是氧化还原反应,故选;
⑦实验室用氯化铵和氢氧化钙反应制取氨气,该反应中各元素的化合价都不变,所以不是氧化还原反应,故不选;
⑧实验室用硫化亚铁和稀盐酸制取硫化氢气体,该反应中各元素的化合价都不变,所以不是氧化还原反应,故不选;
实验室利用氧化还原反应才可以制取的气体为③④⑥,
故选D.
点评:本题考查了氧化还原反应,根据反应中是否有元素化合价变化来分析即可,难度不大.
本题难度:一般
5、选择题 下列反应后只可能生成一种有机物的是
A.CH3-CH=CH2与HCl加成
B.CH3-CH2-CH(OH)-CH3在浓硫酸存在下,发生分子内脱水
C.C6H5-CH3在铁粉存在下与氯气反应
D.CH3-CH(OH)-CH3在浓硫酸存在下,发生分子内脱水
参考答案:D
本题解析:
本题难度:一般