1、选择题 某溶液中Cl-,Br-,I-的物质的量之比为2:3:4,要使溶液中的Cl-,Br-,I-的物质的量之比变为4:3:2,则通
入Cl2的物质的量是原溶液中I-的物质的量的
[? ]
A.1/2
B.1/3
C.1/4
D.1/8
2、填空题 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.
族
周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
二
①
②
③
④
三
⑤
⑥
⑦
⑧
⑨
⑩
|
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是______.
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是______(填化学式,下同),具有两性的是______.
(3)⑤⑥⑦单质的活泼性顺序为______>______>______?(填元素符号),判断的实验依据是______?(写出一种).
3、推断题 (三选一)【物质结构与性质】
原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能?层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是___________,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)。
(2)根据等电子原理分析,BC2+?中B原子的轨道杂化类型是____________。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是____________。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第______电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为________;A能形成多种常见单质,在熔点最低的单质中,每个分子周围紧邻的分子数目为___________;?
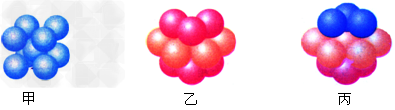
(6)E的基态原子有_____种形状不同的原子轨道;E2+?的价电子排布式为_______;下图_______(填甲、乙或丙)表示的是E晶体中微粒的堆积方式。
4、选择题 X、Y为两种短周期元素,X+核外电子比Y-核外电子少一个电子层,且X+具有与Ne原子相同的核外电子层结构.下列说法不正确的是
A.X原子半径小于Y原子半径
B.X+与Y-核外最外层电子数相同
C.化合物XY的晶体中只存在离子键
D.工业上可以用电解熔融XY的方法得到X、Y元素的单质
5、选择题 下列元素周期表的区域中,含有较多用于制造半导体材料元素的是?
[? ]
A.?金属元素和非金属元素分界线附近?
B.?副族元素
C.?左下方区域的金属元素?
D.?右上方区域的非金属元素