1、选择题 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A.左、下方区域的金属元素
B.金属元素和非金属分界线附近的元素
C.右、上方区域的非金属元素
D.稀有气体元素
参考答案:A、左、下方区域的金属元素的金属性很强,不具有非金属性,故A错误;
B、金属元素和非金属分界线附近的元素,既具有金属性又具有非金属性,则可用于制造半导体材料,故B正确;
C、右、上方区域的非金属元素的非金属性很强,不具有金属性,故C错误;
D、稀有气体元素的单质为气体,性质不活泼,不能用于制造半导体材料,故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 有X、Y、Z三种元素,X和Y可形成XY和XY2两种化合物;Z与X、Y分别形成XZ4和Z2Y两种化合物,这两种化合物的电子总数都为10,则X、Y、Z三种元素分别是
A.C、N、O
B.C、O、H
C.C、H、O
D.H、N、O
参考答案:B
本题解析:由题意得X、Y分别为C、O,组成的化合物为CO2、CO;Z为H,与X、Y组成的化合物分别为CH4、H2O,电子数均为10.
本题难度:简单
3、选择题 甲、乙两种非金属:①甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;②甲比乙更容易与氢气化合;③甲单质能与乙阴离子发生氧化还原反应;④与金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.能说明甲比乙的非金属性强的是( )
A.①②③④
B.①②③
C.①②③④⑤
D.②③④⑤
参考答案:①甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强,则甲的非金属性比乙强,故①正确;
②甲比乙更容易与氢气化合,则甲的非金属性比乙强,故②正确;
③甲单质能与乙阴离子发生氧化还原反应,则甲的非金属性比乙强,故③正确;
④与金属反应时,甲原子得电子数目比乙的多,但得电子不一定容易,则不能说明甲比乙的非金属性强,故④错误;
⑤甲的单质熔沸点比乙的低,无法确定非金属的关系,故⑤错误;
显然①②③能说明甲比乙的非金属性强,
故选B.
本题解析:
本题难度:一般
4、选择题 浓硫酸和浓硝酸是实验室常用的酸,下列关于它们的说法错误的是(?)
A.浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气
B.浓硫酸和浓硝酸都能与金属铜反应
C.浓硫酸和浓硝酸加水稀释后都能与金属铜反应
D.浓硫酸和浓硝酸在常温下都能用金属铝或铁制容器盛放
参考答案:C
本题解析:略
本题难度:简单
5、填空题 (8分)
(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理.?
(2)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式
?
(3)取少量Fe2O3粉末(红棕色)加入适量盐酸,该反应的离子方程式为??;用此溶液进行以下反应,取少量溶液于一支试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为?。
参考答案:(1)Al(OH)3+3HCl=AlCl3+3H2O(2)2NaHCO3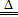 Na2CO3+CO2↑+ H2O
Na2CO3+CO2↑+ H2O
(3)Fe2O3+3H+=Fe3++3H2O ?Fe3++3OH—=Fe(OH)3↓
本题解析:(1)氢氧化铝与盐酸生成氯化铝和水,方程式为Al(OH)3+3HCl=AlCl3+3H2O。
(2)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,方程式为2NaHCO3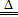 Na2CO3+CO2↑+ H2O。
Na2CO3+CO2↑+ H2O。
(3)氧化铁溶于盐酸生成氯化铁和水,离子方程式为Fe2O3+3H+=Fe3++3H2O,向反应后的溶液中加入氢氧化钠溶液离子方程式为Fe3++3OH—=Fe(OH)3↓。
点评:看清是写化学方程式还是离子方程式。
本题难度:一般