| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》考点强化练习(2017年押题版)(十)
参考答案:C 本题解析:1L 0.5mol/L的NaOH溶液的浓度增大一倍,即改变后的溶液的浓度是1mol/L。A、加入20g的NaOH固体后,溶质的物质的量增大一倍,但由于固体的加入低溶液的体积造成影响,所以溶液的物质的量浓度不一定增大一倍,错误;B、溶液体积变为0.6L,氢氧化钠的物质的量仍是0.5mol,此时溶液的物质的量浓度是0.5mol/0.6L<1mol/L,错误;C、加入10mol/L的NaOH溶液0.1 L,也即加入1mol的氢氧化钠,所以溶液中NaOH的总物质的量是1mol+0.5mol=1.5mol,最终溶液的体积是1.5L,所以此时溶液的浓度是1.5mol/1.5L=1mol/L,正确;D、加入1 L 1.5 mol/L的NaOH溶液即加入了1.5mol的NaOH,溶液中NaOH的总物质的量是2mol,但溶液的体积不是2L,所以溶液的浓度不是1mol/L,错误,答案选C。 本题难度:一般 4、选择题 用NA表示阿伏加德罗常数,下列说法中正确的是 |
参考答案:B
本题解析:①错,18gD2O含有的电子数小于10NA;②错,氟气为双原子分子,而氩气为单原子分子;③正确;④错,标准状况下,SO3不是气体;⑤正确;⑥错,0.1molOH-含NA个电子;⑦错,1mol Na2O2与水完全反应时转移电子数为NA
本题难度:一般
5、计算题 某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
| ? | 甲 | 乙 | 丙 |
| 烧杯+稀硫酸 | 200 g | 150 g | 150 g |
| 加入的铁样品 | 9 g | 9 g | 14 g |
| 充分反应后,烧杯+剩余物 | 208.7 g | 158.7 g | 163.7 g |
参考答案:(1)乙? (2)93.3%? (3)17.1%
本题解析:(1)甲、乙、丙均产生0.3 g H2,甲可看作是在乙的基础上再加50 g H2SO4,丙可看作是在乙的基础上再加5 g铁,均未再多产生气体,说明乙中H2SO4与铁恰好完全反应。
(2)由乙组数据计算:
Fe+H2SO4====FeSO4+H2↑
56? 2
m(Fe)? 0.3 g
m(Fe)=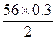 g="8.4" g
g="8.4" g
样品中铁的质量分数w(Fe)=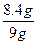 ×100%=93.3%
×100%=93.3%
(3)Fe+H2SO4====FeSO4? +? H2↑
152? 2
m(FeSO4)? 0.3 g
m(FeSO4)=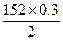 g="22.8" g
g="22.8" g
w(FeSO4)=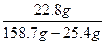 ×100%=17.1%
×100%=17.1%
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《能量的相互.. | |