1、填空题 (1)已知KClO3+NH4NO2→KCl+NH4NO3指出以上反应中的氧化剂是______,被氧化的元素是______?(标出化合价).
(2)将190g?MgCl2溶于水配制成1L溶液.
①该溶液中MgCl2的物质的量浓度为______,溶液中Cl-的物质的量浓度为______.
②配制1mol?L-1的MgCl2溶液500mL,需该溶液的体积为______.
③向②中500mL溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol?L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为______,通入HCl气体的体积(标准状况下)为______.
参考答案:(1)因KClO3中的氯元素的化合价由+5价降低到-1价,所以KClO3是氧化剂,NH4NO2中亚硝酸根离子上的N由+3价升高到+5价,被氧化,故答案为:KClO3;
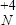
(2)①MgCl2的物质的量为n(MgCl2)190g95g/mol=2mol,则MgCl2物质的量浓度为C(MgCl2)2mol1L=2 mol/L,溶液中Cl-的物质的量浓度C(Cl-)=2C(MgCl2)=4mol/L,故答案为:2mol/L;4mol/L;
②因溶液稀释前后溶质的物质的量不变,所以需该溶液的体积为V=1mol/L×0.5L2mol/L=0.25L,故答案为:0.25L;?
③因②中Cl-的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl-的物质的量浓度为1mol/L,H+的物质的量浓度也为1mol/L,
HCl的物质的量为:1mol/L×0.5L=0.5mol,体积为0.5mol×22.4L/mol=11.2L,故答案为:1mol/L;11.2L.
本题解析:
本题难度:一般
2、选择题 向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法正确的是
A.Cu与Cu2O 的物质的量之比为1:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
参考答案:D
本题解析:39.2g沉淀是氢氧化铜,物质的量是0.4mol。如果设铜和氧化亚铜的物质的量分别是x和y,则64x+144y=27.2g和x+2y=0.4mol,解得x=0.2mol,y=0.1mol,所以选项A不正确;反应中共转移电子是0.2mol×2+0.1mol×2=0.6mol,所以根据电子的得失守恒可知,生成NO是0.6mol÷3=0.2mol,但体积不一定是4.48L,选项C不正确;生成物硝酸钠是1mol,所以原硝酸的物质的量是1mol+0.2mol=1.2mol,浓度是1.2mol÷0.5L=2.4mol/L,选项B不正确;生成硝酸铜是0.4mol,所以剩余硝酸是1.2mol-0.4mol×2-0.2mol=0.2mol,选项D正确,答案选D。
本题难度:简单
3、填空题 某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,并取出100mL该盐酸溶液与2mol/L的Ba(OH)2溶液进行中和反应。
(1)根据公式 ,可知该HCl气体的物质的量为________。
(2)根据公式 ,可知所配成的盐酸溶液的物质的量浓度为 。
(3)100mL盐酸溶液中含HCl的物质的量为 ,
(4)根据化学反应方程式 ,可知反应过程中n[Ba(OH)2]: n(HCl) = ,所以n[Ba(OH)2]为 mol,因此,反应所消耗的的体积Ba(OH)2为 。
参考答案:(1)n=V/Vm 2mol; (2)C="n/V " 4mol/L (3)0.4mol
(4) 2HCl + Ba(OH)2 = BaCl2 + 2H2O 1:2 0.2 100ml
本题解析:略
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA
B.46g NO2和N2O4的混合气体中含N原子总数为NA
C.标准状况下,5.6L CCl4含有的分子数为0.25NA
D.等物质的量的NH4+和OH-含电子数均为10NA