1、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)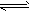 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
________移动(填“向左”、“向右”或“不”);使用催化剂________反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:
O2(g) = O2+(g)+e- △H1=1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) △H2=-771.1 kJ·mol-1
O2PtF6(s)=O2+(g)+PtF6-(g) △H3=482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的△H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为______________________________。已知25℃时
Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显____性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
2、简答题 常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液?②NaHCO3溶液?③盐酸?④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V?mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L?NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.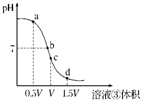
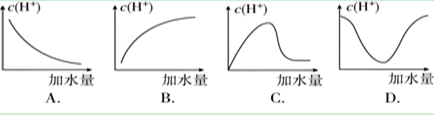
3、选择题 冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是 ( )
4、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A pH=4的醋酸中:c(H+)=4.0molL-1
B 饱和小苏打溶液中:c(Na+)= c(HCO3-)
C 饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
5、选择题 在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol·L-1与Bmol·L-1,则A和B的关系为
A.A>B
B.A=10-4B
C.B=10-4A
D.A=B