1、选择题 将0.05 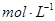 的醋酸溶液加水稀释时,下列说法正确的是(? )
的醋酸溶液加水稀释时,下列说法正确的是(? )
A.溶液中氢氧根离子的浓度增大了
B.c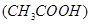 减小,电离平衡向生成醋酸分子的方向移动?
减小,电离平衡向生成醋酸分子的方向移动?
C.平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少
D.电离程度增大,c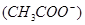 也增大了
也增大了
参考答案:A
本题解析:醋酸是弱酸,存在电离平衡CH3COOH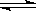 CH3COO-+H+。稀释促进电离,氢离子的个数增加,但氢离子浓度降低,,所以溶液中氢氧根离子的浓度增大,A正确,B和C以及选项D都是错误的,答案选A。
CH3COO-+H+。稀释促进电离,氢离子的个数增加,但氢离子浓度降低,,所以溶液中氢氧根离子的浓度增大,A正确,B和C以及选项D都是错误的,答案选A。
考点;考查外界条件对电离平衡的影响
点评:在稀释醋酸时,需要搞清楚促进电离,但溶液的酸性不一定是增强的。这是由于浓度和物质的量以及溶液的体积都有关系。虽然促进电离,生成的氢离子的物质的量增加,但溶液的体积增大的程度更大,因此氢离子浓度还是降低的,在进行有关判断时需要注意这一点。
本题难度:一般
2、选择题 1mL pH值相同的醋酸和盐酸,分别用蒸馏水稀释到l00mL,稀释后两溶液的pH分别为m和n
[? ]
A.m>n
B.m=n
C.m<n
D.不能确定
参考答案:C
本题解析:
本题难度:一般
3、选择题 H2S溶液中,在采取措施使pH增大的同时,则c(S2-)的变化情况是
[? ]
A.增大
B.减小
C.不变?
D.可能增大,也可能减小
参考答案:D
本题解析:
本题难度:简单
4、选择题 将0.1mol?L-1的醋酸钠溶液20mL与0.1mol?L-1的盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)>c(H+)>c(CH3COOH)>c(Cl-)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
参考答案:将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,
A.HAc为弱电解质,部分电离,应有c(HAc)>c(H+),故A错误;
B.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),HAc为弱电解质,部分电离,应有c(HAc)>c(H+),故B错误.
C.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),故C错误;
D.溶液遵循电中性原则,应有c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-),故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性变化不大但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是(?)
A.NaOH溶液?
B.蒸馏水?
C.Na2SO3溶液?
D.KI溶液)
参考答案:C
本题解析:本题错解之一是由于思维定势,对液体吸收气体容量大简单地理解为溶解度较大。常温下氯气在水中的溶解度为1∶2,属于可溶范围,符合吸收容量大的条件;再考虑氯气溶于水生成盐酸和次氯酸的导电性比蒸馏水大大增强,灵敏度也好。因此,选择了B选项。实际上气体的溶解度表示的是在1L水中溶解的气体体积数,而相同物质的量的气体和液体、固体在体积上相差一千倍左右,如1mol任何气体在标准状况下的体积为22.4L;1mol水18 mL。若1L溶液中含有1mol溶质,它吸收1mol的气体(22.4L),比溶解的气体多得多,何况溶质的物质的量大,吸收的容量将更大。错解之二是知识欠缺,只知道氯气能和NaOH溶液反应,生成氯化钠和次氯酸钠,生成物的种类增多,导电的离子浓度增大。因此,兼顾容量和导电性变化的灵敏度,实际上氯气和氢氧化钠的反应如下:Cl2+2NaOH NaCl+NaClO+H2O,2mol NaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电能力不变。由于氯气和亚硫酸钠发生如下反应:Cl2+Na2SO3+H2O
NaCl+NaClO+H2O,2mol NaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电能力不变。由于氯气和亚硫酸钠发生如下反应:Cl2+Na2SO3+H2O 2HCl+Na2SO4,从吸收容量上看,用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电荷总量看),符合导电性增强。选项C为正确答案。
2HCl+Na2SO4,从吸收容量上看,用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电荷总量看),符合导电性增强。选项C为正确答案。
本题难度:简单