1、填空题 金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数的值,M表示金的相对原子质量。
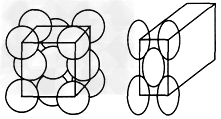
(1)金晶体每个晶胞中含有____个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定____。
(3)一个晶胞的体积是多少?____________
(4)金晶体的密度是多少?____________
参考答案:(1)4?
(2)金原子间相接触?
(3)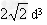
(4)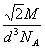
本题解析:
本题难度:一般
2、填空题 (三选一)【化学-- 选修物质结构与性质】
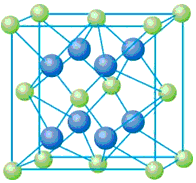
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如右图。请回答
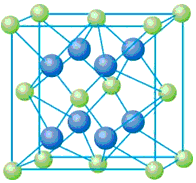
(1)A与C形成的共价化合物的分子式是__________,杂化轨道类型是__________,分子的立体结构是
__________。
(2)B与C比较,电负性较小的是_______(填元素符号);B与C形成的化合物晶体类型是_________。
(3)E属元素周期表中第_____周期,第______族的元素,其元素名称是________,它的+2价离子的电子排布式为__________。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为__________;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是__________(只要求列出算式)。
参考答案:(1)SiH4 ;sp3 ;正四面体?
(2)F;分子晶体
(3)四; ⅡB;锌;1s22s22p43s23p63d10
(4)CaF2?;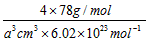
本题解析:
本题难度:一般
3、填空题 (3分)①NaCl、②干冰、③冰、④Na2O2、⑤白磷(P4)、⑥金刚石、⑦Na2CO3、⑧钠。以上物质中属于离子晶体的是? ________ ;属于分子晶体的是?(填序号)。氯化钡是无色晶体,溶于水,水溶液能导电,熔点1 560 ℃。它可能属于? ______ 晶体。
参考答案:①④⑦、②③⑤、离子
本题解析:只要存在离子键即是离子晶体;金属单质是金属晶体;原子晶体只有金刚石,其余的为分子晶体。所以属于离子晶体的是①④⑦,属于分子晶体的是②③⑤,氯化钡可能属于离子晶体。
本题难度:一般
4、实验题 有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对三种晶体元素进行实验,结果如下表:
代号
| 熔点
| 硬度
| 水溶性
| 导电性
| 水溶液与Ag+反应
|
A
| -114.2 ℃
| 很小
| 易溶于水
| 水溶液导电,液态不导电
| 有白色沉淀产生
|
B
| 801 ℃
| 较大
| 易溶于水
| 溶于水或熔化均导电
| 有白色沉淀产生
|
C
| 3 350 ℃
| 很大
| 不溶于水
| 不导电
| 无反应
|
根据表中的有关事实,完成下列问题。?
(1)写出晶体的化学式:A?,B?,C?。?
(2)晶体类型:A?,B?,C?。?
(3)组成晶体的微粒:A?,B?,C?。?
(4)晶体中微粒间的作用力:A?,B?,C?。
参考答案:(1)HClNaClC?
(2)分子晶体离子晶体原子晶体?
(3)HCl分子Na+、Cl-?C原子?
(4)分子间作用力离子键共价键?
本题解析:根据表中所列性质,A的熔点低、硬度小,应为分子晶体,易溶于水且水溶液导电,则为极性分子,可与Ag+反应生成白色沉淀,说明含Cl-,所以A为HCl。B的熔点较高,硬度较大,且易溶于水,溶于水后能导电,说明为离子晶体,能与Ag+反应生成白色沉淀,说明含有Cl-,所以B为NaCl。C的熔点很高,硬度很大,且不溶于水,不导电,应为原子晶体。所以C为金刚石。?
本题难度:一般
5、填空题 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如右图。请回答
(1)A与C形成的共价化合物的分子式是__________,杂化轨道类型是__________,分子的立体结构是
__________。
(2)B与C比较,电负性较小的是_______(填元素符号);B与C形成的化合物晶体类型是_________。
(3)E属元素周期表中第_____周期,第______族的元素,其元素名称是________,它的+2价离子的电子排布式为__________。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为__________;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是__________(只要求列出算式)。
参考答案:(1)SiH4 ;sp3 ;正四面体?
(2)F;分子晶体
(3)四; ⅡB;锌;1s22s22p43s23p63d10
(4)CaF2?;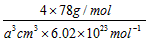
本题解析:
本题难度:一般