1、简答题 元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分.现请针对表中的A~I种元素,回答问题.
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族
2
A
B
C
3
D
E
F
G
H
4
I
|
(1)根据下列要求,用序号填写:
①最不活泼的元素是______;②金属性最强的元素是______;③氧化物、氢氧化物均具有两性的元素是______;
④第二周期元素中,最高正化合价与最低负化合价绝对值相等的元素是______.
(2)元素B对应氢化物的水溶液呈碱性的原因是______(用电离方程式表示).
(3)写出下列反应的化学方程式:①元素I与水反应的化学方程式:______;②元素F的氧化物与NaOH溶液反应的化学方程式:______.
(4)写出元素G的单质与NaOH反应的离子方程式:______.
参考答案:(1)①稀有气体元素化学性质稳定,图中H是Ar,是稀有气体元素故答案为:H;
?②元素周期表中,同周期元素从左到右金属性逐渐减弱,同主族从元素从下到上金属性逐渐减弱,所以金属性最强的元素在最左下角位置,即为K,故答案为:I;
?③氧化铝和氢氧化铝均具有两性,所以氧化物、氢氧化物均具有两性的元素是Al,故答案为:E;
④元素最高正化合价与最低负化合价绝对值之和是8,最高正价等于最外层电子数等于族序数,最高正化合价与最低负化合价绝对值相等,所以最外层电子数为4,是第ⅠⅤA族元素,
故答案为:A;
(2)氨水能电离出氢氧根离子,而显碱性,故答案为:NH3?H2O?

NH4++OH-;
(3)①金属钾和水剧烈反应生成氢氧化钾和氢气,即2K+2H2O=2KOH+H2↑,故答案为:2K+2H2O=2KOH+H2↑;
②二氧化硅是酸性气体,能和氢氧化钠反应生成硅酸钠和水,即SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(4)氯气和水反应生成盐酸和次氯酸,盐酸是强酸,次氯酸是弱酸,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
本题解析:
本题难度:一般
2、选择题 R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R、M的最高价氧化物水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强
B.HnJOm为强酸,则G是位于VA族以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素
参考答案:A.同周期元素从左到右元素的金属性逐渐减弱,对应的最高价氧化物的水化物的碱性逐渐减弱,故A正确;
B.若HnJOm为强酸,如J为S元素,则G可能为Si,故B错误;
C.若T的最低化合价为-3,则J的最高正化合价为+7,故C错误;
D.若M的最高正化合价为+4,R可能为Na、Mg、Al等金属元素,故D错误.
故选A.
本题解析:
本题难度:一般
3、简答题 根据元素周期表,判断下列元素中不属于主族元素的是( )
A.钙
B.铁
C.磷
D.碘
参考答案:A、钙元素在第ⅡA,属于主族元素,故A不选;
B、金属铁属于ⅤⅢ族元素,不属于主族元素,故B选;
C、磷元素在第ⅤA,属于主族元素,故C不选;
D、碘元素在第ⅤⅡA,属于主族元素,故D不选.
故选B.
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知2H2(g)+O2(g)=2H2O(l)△H= -571kJ·mol-1 则氢气的燃烧热为-285.5kJ·mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
A.只有②④⑥
B.只有①⑤⑥
C.只有②③④
D.只有③⑤⑦
参考答案:A
本题解析:①错,氢化物的稳定性是比较对应元素的非金属性强弱,非金属性越强,氢化物越稳定;②正确;③错,ⅠA、ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布;④正确;⑤错,多电子原子中,在离核较近的区域内运动的电子能量较低;⑥正确;⑦错,非金属性的强弱与反应条件无关;
本题难度:简单
5、简答题 表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)上述所列元素中,最高价氧化物的水化物中酸性最强的是______(填化学式).
(2)d、e、f三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)______.
(3)a、c两种元素可形成多种化合物,其中化合物A的产量是衡量一个国家石油化工发展水平的标志,则:
①A的结构简式为______;以A为原料,可制得当今世界上产量最大的塑料产品,该反应的化学方程式为______;
②A可与H2O反应生成化合物B,该反应类型为______.B与CH3COOH反应生成有果香气味的产物,该反应的化学方程式为______.
(4)从b、f形成的化合物与d、f形成的化合物的混合物中分离提纯d、f形成的化合物,可加入上述______(用元素符号表示)两种元素形成的化合物的水溶液后再过滤洗涤.
(5)元素e的气态氢化物与其最高价氧化物的水化物反应生成的物质为______(用化学式表示),该物质所含化学键类型为______,属于______化合物(填“离子”或“共价”).
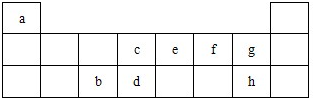
参考答案:根据元素所在周期表中的位置可知a为H元素,b为Al元素,c为C元素,d为Si元素,e为N元素,f为O元素,g为F元素,h为Cl元素,
(1)HClO4是酸性最强的无机含氧酸,故答案为:HClO4;
(2)非金属性越强氢化物越稳定,由元素在周期表的位置可知,非金属性Si<N<O,故氢化物稳定性SiH4<NH3<H2O,故答案为:SiH4<NH3<H2O;
(3)H、C两种元素可形成多种化合物,化合物A的产量是衡量一个国家石油化工发展水平的标志,则A为乙烯,
①A的结构简式为C2H4,乙烯发生加聚反应得到聚乙烯,方程式为: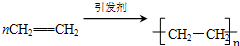 ,
,
故答案为:C2H4; ;
;
②乙烯与水发生加成反应生成的B,B为CH3CH2OH,以乙酸反应生成乙酸乙酯,方程式为:CH3COOH+CH3CH2OH浓硫酸
本题解析:
本题难度:一般