1、实验题 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠(CH3COONa)。将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按下图连接好装置进行实验,当试管乙中有明显现象时停止实验。
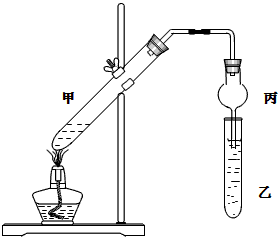
试回答:
(1)实验时,应对试管甲缓慢加热,其目的是________________________。
(2)写出试管甲中发生反应的化学方程式:________________________。
(3)加入浓硫酸的作用是______________、_________________、___________________。
(4)该实验中球形管丙的作用是________________________。
(5)某同学做此实验时,观察到反应混合液变黑,并闻到刺激性气味,试分析其原因:________________________
参考答案:(1)减少乙醇、乙酸的挥发,减少副反应的发生
(2)CH3COONa+H2SO4→CH3COOH+NaHSO4,CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 或:CH3COONa+H2SO4+CH3CH2OH
CH3COOCH2CH3+H2O 或:CH3COONa+H2SO4+CH3CH2OH CH3COOCH2CH3+NaHSO4+H2O
CH3COOCH2CH3+NaHSO4+H2O
(3)反应物(或制取乙酸)、催化剂、吸水剂
(4)防止倒吸
(5)加热温度过高使有机物脱水有碳生成,浓硫酸被还原为SO2
本题解析:
本题难度:一般
2、填空题 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
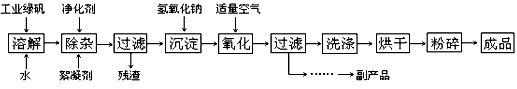
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
请回答下列问题:
(1)铁的常见氧化物有_________________ ;
(2)Fe3O4与稀硝酸反应的离子方程式是___________ ,检验反应后的溶液中含Fe3+的方法_______ ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:____________________ ;
(4)生产中可获得的副产品是__________,提取该副产品的操作顺序是_________ (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为_______________ m3/h(假设反应在标准状态下进行,空气中O2占20%)。
参考答案:(1)FeO、Fe2O3、Fe3O4
(2)3Fe3O4 + 28H++NO3-=9Fe3++NO↑+14H2O;取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+
(3)4Fe(OH)2+2H2O+O2=4Fe(OH)3
(4)Na2SO4·10H2O(或芒硝,写Na2SO4也可); bcdae
(5)0.784
本题解析:
本题难度:一般
3、选择题 下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是
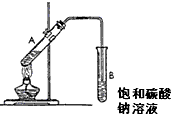
[? ]
A.向A试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B.试管B中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管A的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管B中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
参考答案:A
本题解析:
本题难度:一般
4、实验题 氯化铵是一种重要的化工原料,应用广泛。
(1).实验室通常用NH4Cl固体与其它碱性物质混合加热制取氨气。
①写出实验室制取氨气的反应方程式_____________ 。
②将酚酞溶液滴加到氨水中溶液呈红色,其原因是___________ 。(用化学方程式表示)
③浓氨水可以用来检验有毒气体(如:氯气)的泄漏,反应式为3Cl2 +8NH3 ==N2 + 6NH4Cl,在该反应中,氧化剂是 _________(填化学式),检测时观察到的现象是_________ ,当有1mol氮气生成时,转移的电子数是___________ mol。
(2).用浓氯化铵溶液处理过的舞台幕布不易着火,其原因是__________ (填字母)
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔绝了空气
A.①②
B.③④
C.①③
D.②④
(3).实验室还用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应式为:
NaNO2+NH4Cl=NaCl+N2↑+2H2O
实验装置如下图所示,试回答:
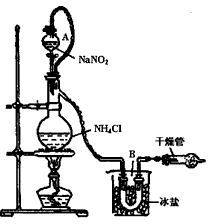
① 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是___________ (填写编号) 。
a. 防止饱和溶液蒸发
b. 保证实验装置不漏气
c. 使饱和NaNO2溶液容易滴下
② B部分的作用是_____________ (填写编号)。
a. 冷凝
b. 冷却氮气
c. 缓冲氮气流
③ 加热前必须进行的一个操作步骤是____________。
④收集N2最适宜的方法是___________ (填写编号) 。
a. 用排气法收集在集气瓶中
b. 用排水法收集在集气瓶中
c. 直接收集在球胆或塑料袋中
参考答案:(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;NH3·H2O
CaCl2+2NH3↑+2H2O;NH3·H2O NH4++OH-; Cl2;大量白烟;6;
NH4++OH-; Cl2;大量白烟;6;
(2)B
(3)c;a;检查装置的气密性;c
本题解析:
本题难度:一般
5、实验题 (二选一)【实验化学】
呋喃甲醇和呋喃甲酸是有机合成中的常用试剂,可用呋喃甲醛制备,其实验原理为

制备方法如下:
①在50mL烧杯中放置3.28mL(0.04mol)呋喃甲醛,并用冰水冷却;称取1.6gNaOH溶于少量水中,在搅拌下滴加氢氧化钠水溶液于呋喃甲醛中。
②在8~12℃下连续搅拌40min。
③向反应混合物加入适量水使其恰好完全溶解,用乙醚萃取分液。
④乙醚萃取物用无水硫酸镁干燥后,先在水浴中蒸去乙醚,然后蒸馏,收集169~172℃馏分得1.4g产品。
⑤在乙醚提取后的水溶液中慢慢滴加浓盐酸到pH=3,搅拌,冷却,结晶,抽滤。
⑥产物用少量冷水洗涤,抽干后,收集粗产物。再提纯后得精产品1.5g。
(1)本实验中,氢氧化钠必须溶于少量的水,否则水量过大主要会影响______收率。
(2)本实验中要充分连续搅拌40min,其目的是_________________。
(3)萃取时,用到的主要硅酸盐质的仪器是_________;抽滤的优点是____________。
(4)呋喃甲酸粗产品提纯的方法是________________________。
(5)本实验中呋喃甲酸的产率为_____________?。
参考答案:(1)呋喃甲酸
(2)这是在两相中进行的反应,长时间充分搅拌使其充分接触,保证反应完全
(3)分液漏斗;过滤和洗涤速度加快,母液和晶体分离较完全,且产品易干燥
(4)重结晶
(5)67%
本题解析:
本题难度:一般