1、实验题 实验室用固体烧碱配制500ml,0.1mol/LNaOH溶液
(1)需要称取__________g的烧碱固体,固体应放在__________中称量。
(2)配制的过程中不需要使用的仪器是__________(填标号字母)
A.?托盘天平?B.烧杯?C.玻璃棒? D.1000ml的容量瓶?E.碱式滴定管?F.胶头滴管
(3)根据实验的实际需要和(2)中所列出的仪器判断,完成该实验还缺少的玻璃仪器是______________。
(4)在容量瓶内确定溶液体积的过程中,完成后期加入少量的水(即定容)的操作方式是___________________。
(5)下列各项操作中,可能导致实际浓度偏高的是__________。(填选项字母) ?
A.称量NaOH固体时,砝码和物质的位置对调
B.向容量瓶中转移时,不慎洒出
C.NaOH溶解时放出大量的热,未及冷却立即配制溶液
D.定容时,仰视容量瓶的刻度线
E.定容时,加水超过刻度线,再用胶头滴管吸出多余的部分
F.称取氢氧化钠固体时所用的砝码生锈
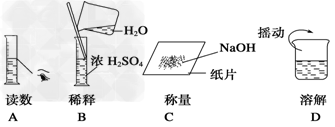
(6)下图分别表示四种操作,其中有两处错误的是?_________
2、填空题 用20gNaOH配成500mL溶液,NaOH的物质的量的浓度为_______________。取出50mL,它的物质的量浓度为_______________,含NaOH的物质的量为_______________,含NaOH的质量为_______________g,把这50mL溶液加水稀释到200mL,NaOH的物质的量浓度为_______________。
3、计算题 (4分)(1)密度为1.17g/cm3,浓度为36.5%的浓盐 酸中HCl的物质的量的浓度为 。
酸中HCl的物质的量的浓度为 。
(2)Na2O和Na2O2的混合物14g和足量的水反应,得到300mL溶液,其中含溶质16g。原混合物中Na2O和Na2O2的质量分别多少 。
4、选择题 某结晶水合物的化学式为A?nH2O,其相对分子质量为M,在25℃时,ag晶体溶于bg水中即达饱和,形成密度为ρg?mL-1的溶液,下列表达式正确的是( )
A.饱和溶液的物质的量浓度为:1000a(M-18n)/M(a+b)mol?L-1
B.饱和溶液中溶质的质量分数为:100a(M-18n)/M(a+b)%
C.饱和溶液的体积为:(a+b)/ρL
D.25℃时,A的溶解度为:100a(M-18n)/bMg
5、简答题 配制2mol/L/的NaOH溶液100mL,需要称取固体NaOH的质量是多少?简述操作步骤.