1、选择题 可逆反应:A2(?)+B2(?) 2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是
2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是

A. A2、B2及AB均为气体,Q>0
B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0
参考答案:B
本题解析:根据图像可知,温度越高,物质AB的物质的量减少,这说明升高温度,平衡向逆反应方向进行,即正反应是放热反应,使用Q大于0;增大压强时物质AB的物质的量也减少,这说明增大压强,平衡向逆反应方向进行,因此正反应是体积增大的,所以AB一定是气体,而反应物A2、B2中至少有一种为非气体,所以答案选B。
本题难度:一般
2、选择题 在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
A.平衡向正反应方向移动了
B.物质A的转化率增大了
C.物质B的质量分数增加了
D.a>b
参考答案:D
本题解析:当容器体积增加一倍,压强减小,B的浓度瞬间变为原来的50%;当达到新的平衡时,B的浓度是原来的60%,则平衡向右移动,故b>a,物质A的转化率增大,物质B的质量分数增加,选D。
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。
本题难度:一般
3、选择题 把3mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+B(g)  xC(g)+2D(g)。5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是
xC(g)+2D(g)。5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是
A.A的平均反应速率为0.15mol/(L·min)
B.平衡时,C的浓度为0.25mol/L
C.平衡时,B的转化率为20%
D.平衡时,容器内压强为原来的0.8倍
参考答案:D
本题解析:根据反应速率之比是相应的化学计量数之比可知,A的反应速率是0.10mol/(L·min)×1.5=0.15mol/(L·min),A正确;B的反应速率是0.05mol/(L·min),即消耗B是0.05mol/(L·min)×2L×5min=0.5mol,所以B的转化率是0.5÷2.5=0.2,选项C正确;由于压强减小,所以x=1,则平衡时C的浓度是0.5mol÷2L=0.25mol/L,选项B正确;平衡时,容器内压强为原来的 ,所以选项D不正确,答案选D。
,所以选项D不正确,答案选D。
本题难度:一般
4、选择题 下列关于冰熔化为水的过程判断正确的是
A.△H>0,△S<0
B.△H<0,△S>0
C.△H>0,△S>0
D.△H<0,△S<0
参考答案:C
本题解析:因为冰熔化需要吸热,所以△H>0;冰熔化成水,分子活动能力增强,混乱度增大,故△S>0。故C 正确。
考点:考察利用公式计算判断自发反应过程。
点评:正确理解焓判据和熵判据。
本题难度:一般
5、选择题 图Ⅰ是NO2(g)+CO(g) CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ。
CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ。
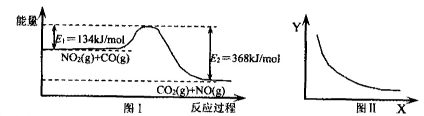
下列有关说法正确的是
A.该反应的焓变△H=234 kJ·mol-1
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
参考答案:C
本题解析:根据图像可知,反应是放热反应,△H小于0,A不正确。CO的浓度越大,则NO2的转化率越大,B不正确。因为正反应是放热反应,所以升高温度平衡向逆反应方向移动,CO2的浓度减小,C正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,D不正确。答案选C。
本题难度:一般