1、计算题 某状态下将1molO2、2molSO2和1molSO3的混合气体压入装有V2O5的密闭容器中平衡时测得混合气体对H2的相对密度为28.5。
求:①反应前混合气体的平均分子量;
②平衡混合气体的平均分子量;
③根据上述计算结果,写出原混合气发生反应的化学方程式;
④求反应的转化率。
2、选择题 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)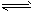 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
|

下列说法正确的是
[? ]
A.反应在t1min内的平均速率为ν(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
3、选择题 在一个固定体积的密闭容器中,加入2 mol A和1 mol B发生反应:2A(g)+B(g)? 3C(g)+D(g),达到平衡时C的浓度为W mol·L-1。若维持容器体积和温度不变,按下列四种方法改变起始物质及其量,达到平衡后C的浓度仍为W mol·L-1的是( )
3C(g)+D(g),达到平衡时C的浓度为W mol·L-1。若维持容器体积和温度不变,按下列四种方法改变起始物质及其量,达到平衡后C的浓度仍为W mol·L-1的是( )
A.4 mol A+2 mol B
B.2 mol A+1 mol B+3 mol C+1 mol D
C.3 mol C+1 mol D+1 mol B
D.3 mol C+1 mol D
4、选择题 用来表示可逆反应:2A(g)+B(g) 2C(g)ΔH<0的正确图象是下图中的(?)
2C(g)ΔH<0的正确图象是下图中的(?)

A? B? C? D
5、填空题 (10分)下图是某温度下,在2L容器中某可逆反应X、Y、Z三种物质的浓度与时间的关系图,根据图中信息回答下列问题:
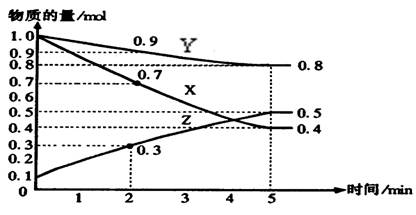
(1)由图中的数据分析,该反应的化学方程式为?;
(2)用X表示的化学反应速率为?mol/(L·min),如果升高温度,达到平衡时的时间会变?(填长、短、不能确定或不变)
(3)5min后Z的生成速率?5min时Z的生成速率(填大于、小于或等于)。
(4)达到平衡时X的转化率为?;