1、选择题 下列相关实验不能表达预期目的是( )
| 相关实验 | 预期目的
A
把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢
验证接触面积对化学反应速率的影响
B
把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化
验证温度对化学平衡的影响
C
在蔗糖中加入适量的硫酸溶液,加热,充分水解后加入新制的氢氧化铜悬浊液并加热,观察沉淀的颜色
验证蔗糖水解产物中有醛基的存在
D
在装有同样浑浊的苯酚溶液的两个试管中,对其中一支试管加热,观察溶液是否变澄清
比较苯酚在不同温度下的溶解度
|
A.A
B.B
C.C
D.D
参考答案:A.相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应,大理石与盐酸反应的接触面积不同,反应速率不同,能达到目的,故A不选;
B.升高温度,导致二氧化氮和四氧化二氮之间的平衡改变而向吸热方向移动,能达到目的,故B不选;
C.在蔗糖中加入稀硫酸,水浴加热,溶液呈酸性,葡萄糖和氢氧化铜的反应必须在碱性条件下反应,不能达到目的,故C选;
D.苯酚加热后溶解度增大,在冷水和热水中的溶解度不同,能达到实验目的,故D不选.
故选C.
本题解析:
本题难度:一般
2、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)

CH3CH2OH(g)+3H2O(g)?下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
参考答案:A、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故A对;
B、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故B错;
C、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C对;
D、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故D对;
故选:B.
本题解析:
本题难度:一般
3、选择题 四氯化硅还原法是当前制备较高纯度硅的一种方法,有关反应的化学方程式为:
SiCl4 + 2H2 4HCl + Si, 下列说法不合理的是
4HCl + Si, 下列说法不合理的是
[? ]
A.反应制得的硅可用于制造半导体材料
B.增大压强有利于加快上述反应的化学反应速率
C.四氯化硅可以由粗硅与氯气通过化合反应制得
D.混入少量空气对上述反应无影响
参考答案:D
本题解析:
本题难度:简单
4、实验题 (14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
催化剂(MnO2)
| 操作情况
| 观察结果
| 反应完成所需的时间
|
粉末状
| 混合不振荡
| 剧烈反应,使木条复燃
| 3.5分钟
|
块状
|
| 反应较慢,火星红亮但木条未复燃
| 30分钟
|
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
双氧水体积
| 操作情况
| 反应完成所需的时间
| 收集到气体体积
| 反应后液体温度
|
a1%的150mL
|
| 11分钟
| 539mL
| 24℃
|
a2%的15mL
| 混合不振荡
| 1分20秒
| 553mL
| 56℃
|
a3%的7.5mL
|
| 9秒
| 562mL
| 67℃
|
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
参考答案:(每空2分,共14分)
(1)①
②催化剂的表面积(聚集状态)
(2)①溶液质量分数不同,液体温度不同
②反应放热相同,但液体的量不同
③液体的量不同,液体温度不同(影响气体在溶液中的溶解量)
(3)①H2O2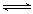 HO2-+H+(H2O2
HO2-+H+(H2O2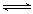 HOO-+H+)
HOO-+H+)
②在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对
本题解析:(1)①双氧水在催化剂的作用下,分解生成氧气,反应的方程式是2H2O2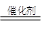 2H2O+O2↑。
2H2O+O2↑。
②根据反应完成所需的时间课判断,催化剂作用的大小与催化剂的表面积(聚集状态)有关系。
(2)①由于溶液的质量分数不同,同时溶液的温度不同,从而导致反应速率不同,所以反应完成所需的时间不同。
②由于双氧水的质量相同,所以反应放出热量相同,但液体的量不同,所以溶液的温度是不同的。
③由于液体的量不同,且液体温度不同,从而影响气体在溶液中的溶解量,所以收集到的氧气是不同的。
(3)①双氧水可以看作是二元弱酸,电离是分步的,即H2O2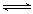 HO2-+H+(H2O2
HO2-+H+(H2O2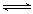 HOO-+H+)。
HOO-+H+)。
②如果是双氧水有较强氧化性所致,则再加入氢氧化钠溶液,是不能显红色的,加粗可以鉴别,即在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对。
本题难度:困难
5、简答题 红矾钠(重铬酸钠:Na2Cr2O7-2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO-Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:
4FeO-Cr2O3(s)+8Na2CO3(s)+7O2?

?8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
该反应的化学平衡常数的表达式为______.
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2min时,曲线发生变化的原因是______(用文字表达).
由图2判断,t2min到t3?min?的曲线变化的原因可能是______(填编号)
a.升高温度?b.加了催化剂?c.将原料粉碎?d.缩小容器体积

(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是______、______.
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是______.
②步骤Ⅳ中发生反应的离子方程式为:______.
参考答案:(1)①根据平衡常数表达式=各个生成物平衡浓度的系数次方的乘积各个反应物平衡浓度系数次方的乘积,所以K=c(CO2)8c(O2)7,故答案为:K=c(CO2)8c(O2)7;
②由图1判断,反应进行至t2min时,二氧化碳的浓度均在原来基础上减小,氧气的浓度在原来基础上是增大的,说明平衡正向移动,可以是降低温度,故答案为:t2?时对平衡体系降温;由图2判断,t2min到t3?min?正逆反应速率加快并且仍相等,化学平衡不移动,则一定是加入了催化剂,故答案为:b;
(2)铬铁矿的主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质,当加入纯碱氧化的过程中,发生副反应:SiO2+Na2CO3?△?.?Na2SiO3+CO2↑、Al2O3+Na2CO3?△?.?2NaAlO2+CO2↑,故答案为:Na[A1(OH)4](或NaA1O2)、Na2SiO3;
①将溶液的pH调至7~8并煮沸,可以将[A1(OH)4]-(或A1O2-)、SiO32-等离子转化为沉淀而除去,故答案为:除去[A1(OH)4]-(或A1O2-)、SiO32-等杂质;
②CrO42-在酸性环境下可以转化为重铬酸根,即2CrO42-+2H+=Cr2O72-+H2O,故答案为:2CrO42-+2H+=Cr2O72-+H2O.
本题解析:
本题难度:一般