1、选择题 在同温同压下,一定量的某有机物和过量的金属钠反应产生aL氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体bL,若a=b,则该有机物可能是?(?)
A.HOOC-CH2OH
B.HOOC-COOH
C.HOCH2-CH2OH
D.CH3COOH
参考答案:A
本题解析:略
本题难度:简单
2、简答题 如图装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
(1)检验此装置A、B部分气密性的操作方法和现象是:______-______.
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:______.
(3)装置D中试管口放置的棉花中应浸有一种液体,这液体是______,其作用是:______.
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)______;
a.水 b.浓溴水 c.KMnO4酸性溶液 d.NaHSO3饱和溶液.
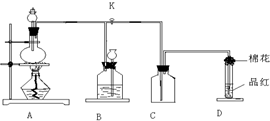
参考答案:(1)将分液漏斗活塞和K关闭,然后加热圆底烧瓶,若装置B中长颈漏斗中的液面上升,说明A、B两处的气密性良好,否则气密性较差,
故答案为:关闭分液漏斗的活塞及K处的活塞,用酒精灯微热烧瓶;若长颈漏斗中的液面上升,说明A、B两处的气密性良好;
(2)烧瓶中铜在加热条件下与浓硫酸反应生成二氧化硫气体、硫酸铜和水,反应的化学方程式为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑;
(3)铜与浓硫酸反应生成的二氧化硫有毒,容易组成大气污染,需要使用碱液溶液吸收多余的二氧化硫,所以该液体可以为氢氧化钠溶液,目的是防止二氧化硫逸出,
故答案为:氢氧化钠溶液;防止二氧化硫逸出;
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体不能导致二氧化硫减少,
a.二氧化硫易溶于水,B中液体不能使用水,故a错误;
b.浓溴水能够氧化二氧化硫,导致二氧化硫减少,故b错误;
c.KMnO4酸性溶液能够氧化二氧化硫,导致二氧化硫减少,故c错误;
d.二氧化硫在饱和亚硫酸钠溶液中溶解度较小,该液体可以为亚硫酸钠饱和溶液,故d正确;
故答案为:d.
本题解析:
本题难度:一般
3、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图

已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1mol FeS2放出热量为853 kJ,则FeS2燃烧的热化学方程式为_________________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为______________________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为______________________(任写一个)。
(4)通过“操作I”可以得到亚硫酸钠品体,写出主要操作步骤的名称:______________。
(5)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)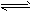 2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
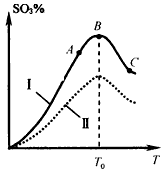
A.该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v正(O2)=v逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
参考答案:(1)4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s) △H= -3412 kJ/mol
(2)SO2+Na2CO3=Na2SO3+CO2↑(或2SO2+Na2CO3+H2O=NaHSO3+CO2↑)
(3)Fe3++3OH-=Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O)
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC
本题解析:
本题难度:一般
4、选择题 丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是(?)
A.与钠反应放出氢气
B.与碳酸氢钠反应
C.能与溴水发生取代反应
D.发生相互加成反应生成高分子化合物
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列画有横线的物质,在反应中不能被完全消耗的是( )
①将含有少量H2O(g)的H2通过盛有足量Na2O2的容器中并不断用电火花点燃
②将1molCu置于含2mol?H2SO4的浓硫酸中加热
③在一定条什下3体积H2和1体积N2在催化剂存在下反应
④在强光持续照射下,向过量的Ca(ClO)2溶液中通入少量CO2.
A.①②
B.②③④
C.②④
D.③④
参考答案:①将含少量H2O的H2气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃,2H2O+2Na2O2=4NaOH+O2,2H2+O2=2H2O,氢气能完全消耗,故①不符合;
②浓硫酸随着反应的进行变为稀硫酸,依据金属活动顺序表可知,铜不与稀硫酸反应,故铜不能消耗完全,故②符合;
③在一定条什下3体积H2和1体积N2在催化剂存在下反应,最终达到化学平衡,不能进行彻底,所以氢气不能被完全消耗,故③符合;
④在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2,发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,光照2HClO=2HCl+O2↑,所以Ca(ClO)2不能完全消耗,故D符合;
故选B.
本题解析:
本题难度:一般