1、填空题 (7分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
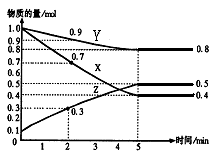
【小题1】由图中的数据分析,该反应的化学方程式为 ;
【小题2】反应开始至2min、5min时Z的平均反应速率分别为 、 ;
【小题3】开始 min后,反应达到最大限度。
参考答案:
【小题1】3X+Y 2Z
2Z
【小题1】0.05mol.L-1.min-1,,0.04mol.L-1.min-1
【小题1】5
本题解析:
(1)根据图像可知X和Y是反应物,Z是生成物,反应进行到2min时X、Y、Z的变化量分别为1.0mol-0.7mol=0.3mol、1.0mol-0.9mol0.1mol、0.3mol-0.1mol=0.2mol,所以反应式为3X+Y 2Z。
2Z。
(2)2min时Z的变化量是0.2mol,5min是Z的变化量是0.5mol-0.1mol=0.4mol,所以Z的反应速率分别为 、
、 。
。
(3)根据图像可知,当反应进行到5min时,各种物质的浓度不再发生变化,所以反应达到平衡状态。
本题难度:一般
2、填空题 (17分)H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
(2)下表是在常压、60℃和不同pH条件下,6mL30% H2O2在60min内释放出氧气的体积。则下列说法正确的是___________。
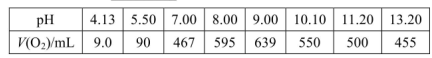
a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30% H2O2分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v(O2)=1.5mL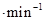
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-
被还原为Mn2+,该反应的离子方程式为______________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_?(填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为_______。若不通空气,则阴极得到的产物是_______ 。
(5)己知断裂1mol化学键所需的能量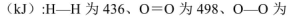
143,H-O为463。则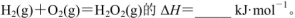 .
.
参考答案:(17分)
(1)催化作用(或催化剂)(2分)? 0.03(2分)
(2)bd(2分)
(3)5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O(3分)
(4)减小(2分)? O2+2H++2e-==H2O2(2分)?H2(2分)
(5)-135(2分)
本题解析:(1)反应的总方程式为2H2O2═2H2O+O2↑,所以Fe2+起到催化剂的作用;O元素由-1价升高至0价,所以对应关系为:O2 ~ 2e?,n(e?)=2×0.336L÷22.4L/mol=0.03mol。
(2)a、pH大于9.00时,反应速率又逐渐减小,错误;b、根据表中数据,pH在9左右,H2O2的分解速率最大,正确;c、60min后反应还可能继续进行,所以6mL 30%的H2O2分解最多释放出的氧气的体积可能大于639mL,错误;d、v(O2)=90mL÷60min=1.5mLmin-1,正确。
(3)MnO4?把H2O2氧化为O2,配平可得离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
(4)阳极H2O失去电子生成的产物含H+,H+浓度增大,所以阳极区溶液的pH减小;阴极O2得电子产生H2O2,电极反应式为:O2+2H++2e-=H2O2;若不通空气,阴极上H+得电子,则阴极得到的产物是H2。
(5)根据各物质含有的共价键可得:?H=436kJ?mol?1+498kJ?mol?1—143kJ?mol?1—2×463kJ?mol?1=-135kJ?mol?1。
本题难度:一般
3、填空题 Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2
| 触摸试管情况
| 观察结果
| 反应完成所需的时间
|
粉末状
| 很烫
| 剧烈反应,带火星的木条复燃
| 3.5min
|
块状
| 微热
| 反应较慢,火星红亮但木条未复燃
| 30min
|
(1)写出上述实验中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ.某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如右图所示,图中数据分析:
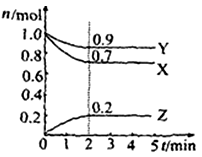
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会减小
A.降低温度 B.加入催化剂 C.增大容器体积
参考答案:Ⅰ(1) 2H2O2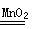 2H2O +O2 ↑ ;2分, 放热;1分(2)催化剂接触面积。1分
2H2O +O2 ↑ ;2分, 放热;1分(2)催化剂接触面积。1分
Ⅱ(1)3X + Y 2Z 2分,(2)0.05 mol·L-1·min-1 2分
2Z 2分,(2)0.05 mol·L-1·min-1 2分
(3)AC 2分,少选得1分,错选不得分
本题解析:Ⅰ(1)H2O2在二氧化锰作用下发生反应的化学反应方程式为2H2O2 2H2O +O2↑,根据试管很烫可知该反应是放热反应。
2H2O +O2↑,根据试管很烫可知该反应是放热反应。
(2)根据表中给出的数据可知,在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明接触面积对反应速率有影响。
Ⅱ(1)由由图象可以看出,X、Y的物质的量逐渐减小,则X、Y为反应物,Z的物质的量逐渐增多,作为Z为生成物,当反应到达2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=3:1:2,所以反应的化学方程式为:3X + Y 2Z。
2Z。
(2)物质Z浓度的变化量为0.2mol÷2L=0.1mol/L,所以Z物质表示的反应速率为01mol/L÷2min=0.05mol/(L·min)。
(3)A、温度较低反应速率一定是减小的,A正确;B、加入催化剂反应速率可以加快,也可能减小,B不正确;C、增大容器容积,物质的浓度减小,则反应速率减小,C正确,答案选AC。
考点:考查外界条件对反应速率的影响以及可逆反应的有关计算
本题难度:一般
4、选择题 、反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.4" mol / (L·s) B.υ(C)="0.5" mol / (L·s)
C.υ(B)="0.6" mol / (L·s) D.υ(A)="0.15" mol / (L·s)
参考答案:B
本题解析:比较反应速率大小要注意统一单位和表示的物质统一。所以在反应A(g)+3B(g) 2C(g)+2D(g)中,以D项υ(A)="0.15" mol / (L·s)为参考标准,则A项υ(D)="0.4" mol / (L·s)转化为υ(A)="1/2υ(D)=0.2" mol / (L·s),B项υ(C)="0.5" mol / (L·s)转化为υ(A)="1/2υ(C)=0.25mol" / (L·s),C项υ(B)="0.6" mol / (L·s)转化为υ(A)="1/3υ(B)=0.2" mol / (L·s),所以比较转化以后的υ(A)的大小,可知B最大,所以选B 。
2C(g)+2D(g)中,以D项υ(A)="0.15" mol / (L·s)为参考标准,则A项υ(D)="0.4" mol / (L·s)转化为υ(A)="1/2υ(D)=0.2" mol / (L·s),B项υ(C)="0.5" mol / (L·s)转化为υ(A)="1/2υ(C)=0.25mol" / (L·s),C项υ(B)="0.6" mol / (L·s)转化为υ(A)="1/3υ(B)=0.2" mol / (L·s),所以比较转化以后的υ(A)的大小,可知B最大,所以选B 。
考点:本题考查的是反应速率大小比较。
本题难度:一般
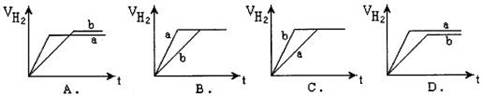
5、选择题 等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是(?)
参考答案:A
本题解析:向a中加入少量的CuSO4溶液,部分锌和硫酸铜反应,生成的氢气减少,生成的铜覆盖在锌的表面,构成原电池,加快反应速率,故选A。
本题难度:一般