1、填空题 把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图所示。其中t1—t2速率变化的主要原因是______________________________;t2—t3速率变化的主要原因是________________________________________。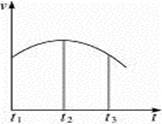
参考答案:(1)反应是放热反应,温度升高使化学反应速率提高
?(2)Hcl的物质的量浓度变小,使化学反应速率降低
本题解析:略
本题难度:一般
2、选择题 一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是
[? ]
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸
A.①③④
B.①③⑤
C.②④⑥
D.②⑤⑥
参考答案:B
本题解析:
本题难度:一般
3、选择题 对于A2+3B2?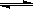 ?2AB3反应来说,以下反应速率表示反应最快的是(?)
?2AB3反应来说,以下反应速率表示反应最快的是(?)
A.v(AB3)=0.5 mol/(L·min)
B.v(B2)=0.6 mol/(L·min)
C.v(A2)=0.4 mol/(L·min)
D.无法判断
参考答案:C
本题解析:将所有速率都转化成同一物质A2来表示。A、等价于v(A2)=0.25 mol/(L·min);B、v(A2)=0.2 mol/(L·min);所以C正确。
本题难度:一般
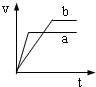
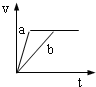
4、选择题 将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是( )
A.
B.
C.
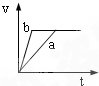
D.
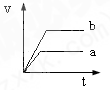
参考答案:由题意可知,反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,
且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,所以a反应速率快,达到反应结束时的时间短,显然只有B图象符合,
故选B.
本题解析:
本题难度:简单
5、选择题 已知反应4NH3+5O2 4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
A.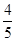 v(NH3)=v(O2)
v(NH3)=v(O2)
B.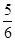 v(O2)=v(H2O)
v(O2)=v(H2O)
C. v(NH3)=v(H2O)
v(NH3)=v(H2O)
D.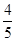 v(O2)=v(NO)
v(O2)=v(NO)
参考答案:D
本题解析:根据反应速率之比是相应的化学计量数之比可知,v(H2O)=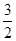 ?v(NH3)=
?v(NH3)=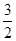 v(NO)= v(O2),所以选项D正确,答案选D。
v(NO)= v(O2),所以选项D正确,答案选D。
本题难度:一般