1、选择题 下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
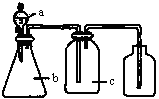
编号
| 气体
| a
| b
| c
|
A
| NH3
| 浓氨水
| 生石灰
| 碱石灰
|
B
| CO2
| 盐酸
| 碳酸钙
| 饱和NaHCO3
|
C
| NO
| 稀硝酸
| 铜屑
| H2O
|
D
| NO2
| 浓硝酸
| 铜屑
| NaOH溶液
|
?
参考答案:B
本题解析: A、NH3不能用向上排气法收集,错误;B、用饱和NaHCO3除去CO2中混有HCl,CO2能用向上排气法收集,正确;C、NO接触氧气会被氧化为NO2,错误。D、NaOH溶液会与NO2反应,错误。
本题难度:一般
2、填空题 资料显示:“氨气可在纯氧中安静燃烧,其燃烧产物对环境没有污染。”
某学校化学小组的学生设计如图装置(图中铁夹等夹持装置已略去),进行氨气与氧气在不同条件下反应的实验。
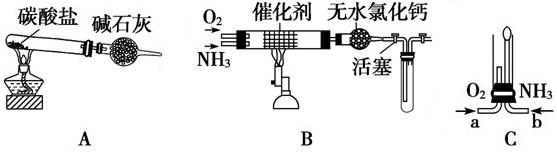
(1) 用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是?;
碱石灰的作用是?;
(2) 将产生的氨气与过量的氧气通到装置B (催化剂为铂石棉)中,用酒精喷灯加热,
氨催化氧化的化学方程式是?;
试管内气体变为红棕色,该反应的化学方程式是?;
(3) 将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端
点燃氨气,氨气在纯氧中燃烧的化学方程式是?。
参考答案:
(1)? (NH4)2CO3?(填NH4HCO3给1分) ?吸收水和二氧化碳
(2)? 4NH3+5O2 ?4NO+6H2O? 2NO+O2===2NO2
?4NO+6H2O? 2NO+O2===2NO2
(3) ?4NH3+3O2 ?2N2+6H2O
?2N2+6H2O
本题解析:(1)A装置中制备铵氨气,需要铵盐,所以应该为碳酸铵固体。碱石灰的作用是吸收碳酸铵分解后的水和二氧化碳。(2)氨气催化氧化生成一氧化氮和水。气体变为红棕色说明生成了二氧化氮(3)如果在纯氧气中燃烧,则生成的产物是氮气和水。
点评:本题涉及到了氨气的化学性质,在制备氨气的过程中利用了固体铵盐加热分解的性质,此套装置需要学生熟练掌握。氨气的催化氧化中需要注意方程式的书写,以及产物的性质。
本题难度:一般
3、选择题 下列各组气体在常温下能共存且能用向上排空气法收集的是
A.NO和O2
B.H2和CO
C.HCl和NH3
D.SO2和CO2
参考答案:D
本题解析:试题分析:A、2NO+O2=2NO2;B、H2,CO密度均小于空气密度,要用向下排空气法收集;C、HCl+NH3=NH4Cl;D、SO2和CO2不反应,且两者密度均大于空气密度可用向上排空气法收集。
本题难度:简单
4、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的是(?)
A.所用NaOH已经潮解
B.向容量瓶加水时液面低于刻度线即摇匀
C.有少量NaOH溶液残留在烧杯内
D.向容量瓶加水时眼睛一直仰视液面
参考答案:B
本题解析:略
本题难度:简单
5、选择题 某同学用下列装置制备并检验Cl2的性质。
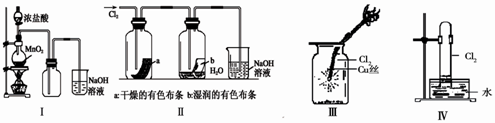
下列说法错误的是
A.Ⅰ图中:即使MnO2过量,盐酸也不能全部消耗
B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
C.Ⅲ图中:生成棕色的烟
D.Ⅳ图中:水可以充满试管
参考答案:D
本题解析:A、因为MnO2与浓盐酸反应,所以随着反应的进行,浓盐酸变为稀盐酸时,反应停止,正确;B、Cl2与H2O反应生成的HClO具有漂白性,能使湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,NaCl、NaClO与H2SO4反应生成Cl2,正确;C、铜丝在氯气中燃烧,产生棕色的烟,正确;D、Cl2与H2O反应生成HCl和HClO,HClO分解生成O2,所以水不可能充满试管,错误。
本题难度:一般