1、实验题 (13分)实验室用下列方法测定某水样中O2的含量。
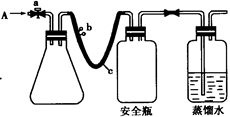
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为?。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是?;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴?作指示剂;
⑧用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为?(单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将?(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是?。
2、简答题 如图均为实验室收集气体的装置.
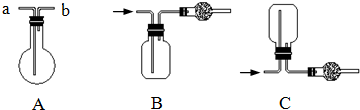
请回答:
(1)可用装置B收集的气体是______(填序号),可用装置C收集的气体是______(填序号).
①Cl2②NH3
(2)若用装置A收集CH4,则气体应从______(填“a”或“b”)口进入烧瓶.
(3)在如图收集NH3的装置中,干燥管中的试剂是______.
3、选择题 《Inorganic Syntheses》(无机合成)一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。
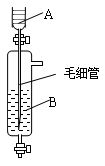
该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
4、选择题 在制备硝酸钾晶体实验中,先后进行了二次过滤,分别是
A.先热过滤,后常温减压过滤
B.先常温常压过滤,后常温减压过滤
C.先常温减压过滤,后热过滤
D.两次都用减压过滤
5、实验题 (每空2分,共18分)现有A、B、C、D、E五种物质,并存在如下转化关系.其中E为黑色粉末,在下图转化中均作催化剂
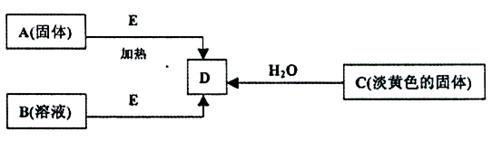
(1)B的化学式?
(2)利用下图所示的实验装置进行C与水的反应,回答下列有关同题:

①?固体C与水反应生成D的化学方程式为:?.
②?检验导管出口气体的方法为:?.
③烧杯中的现象为:?.
(3)在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X.为检验X的性质,设计如下图所示实验装置:
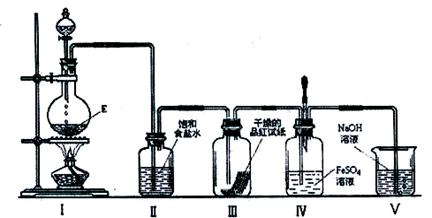
①实验过程中,观察到装置Ⅲ中的品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象.为了达到这一预期现象,你认为应该如何改进?
?。
②实验结束后,装置Ⅳ中可观察到现象是 ,若滴加两滴胶头滴管中的试剂,观察到溶液呈血红色,有关的离子方程式为:
?, 。
③X是一种重要的化工原料,用化学方程式表示X在化工生产上的一项用途:
??。