1、实验题 (13分)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
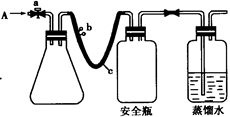
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为?。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是?;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴?作指示剂;
⑧用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为?(单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将?(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是?。
参考答案:(1)2Mn2++O2+4OH-=2MnO(OH)2?
(2)①赶走装置内空气,避免空气中的O2的干扰?⑦淀粉溶液
(3)①7.8mg·L—1?(3分)?②偏大?
③若碱过量,则Mn(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应
本题解析:(1)注意从题给条件中挖掘信息:反应物有O2、OH-(在碱性条件下)、Mn2+,发生氧化还原反应,生成MnO(OH)2,利用化合价升降相等配平O2、Mn2+、MnO(OH)2系数,再利用电荷守恒配平OH-的系数,最后可用原子守恒检查方程式的配平是否正确;
(2)①—④完成后,发生2Mn2++O2+4OH-=2MnO(OH)2?,
⑤—⑥完成后,发生MnO(OH)2+2I—+4H+=Mn2++I2+3H2O,
⑦—⑧完成后,发生I2+2Na2S2O3=2NaI+Na2S4O6,故⑦中淀粉做指示剂,颜色变化为蓝色变无色
(3)①根据(1)中的三个方程式,可以看出物质间的定量关系:
O2 →2 MnO(OH)2 → 2 I2 → 4 Na2S2O3,
即该题的思路是利用Na2S2O3溶液定量测定某水样中O2的含量;
O2? →→→→ 4 Na2S2O3,
1? 4
n(O2)? 0.005 mol · L—1×(3.90×10-3)L=1.95×10-5 mol
则n(O2)= 1.95×10-5 mol÷4=4.875×10-6 mol
此水样中氧(O2)的含量为[(4.875×10-6 mol)×32g.mol-1×1000mg.g-1]/0.02L=7.8mg·L—1;
②“若未用Na2S2O3标准溶液润洗滴定管”,则C(Na2S2O3)减小,V(Na2S2O3)增大即滴定管的读数增大,所以n(O2)增大,故测得水样中O2的含量将偏大;
本题难度:一般
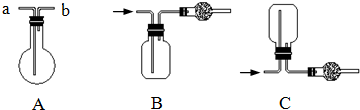
2、简答题 如图均为实验室收集气体的装置.
请回答:
(1)可用装置B收集的气体是______(填序号),可用装置C收集的气体是______(填序号).
①Cl2②NH3
(2)若用装置A收集CH4,则气体应从______(填“a”或“b”)口进入烧瓶.
(3)在如图收集NH3的装置中,干燥管中的试剂是______.
参考答案:(1)装置B收集的方法为向上排空气法,装置C的收集方法为向下排空气法,①Cl2 密度比空气大,可用向上排空气法,NH3
密度比空气小,可用向下排空气法,故答案为:①;②;
(2)甲烷密度比空气小,采用向下排空气法,故从b进,故答案为:b;
(3)干燥氨气应用碱性试剂,可用碱石灰,故答案为:碱石灰.
本题解析:
本题难度:一般
3、选择题 《Inorganic Syntheses》(无机合成)一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。
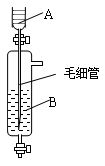
该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
参考答案:B
本题解析:
A、B两选项中,B正确,当浓盐酸慢慢流下后,经浓硫酸吸水,HCl气体逸出;C、D选项中,氢氧化钠浓溶液没有吸水性,不能得到干燥的纯净氨气;选B。
本题难度:一般
4、选择题 在制备硝酸钾晶体实验中,先后进行了二次过滤,分别是
A.先热过滤,后常温减压过滤
B.先常温常压过滤,后常温减压过滤
C.先常温减压过滤,后热过滤
D.两次都用减压过滤
参考答案:A
本题解析:制备KNO3是利用不同物质的溶解度随温度改变而发生不同变化的原理。在NaNO3和KCl的混合溶液中,同时存在?Na+、K+、Cl-?和?NO3-?四种离子。升高温度,NaCl的溶解度几乎没有多大改变,而KNO3的溶解度却增大得很快。在高温下,?蒸发溶剂,达到饱和的NaCl先结晶分离。然后,冷却降温,?KNO3达到饱和,析出晶体,得到粗产品。所以答案选A。
本题难度:简单
5、实验题 (每空2分,共18分)现有A、B、C、D、E五种物质,并存在如下转化关系.其中E为黑色粉末,在下图转化中均作催化剂
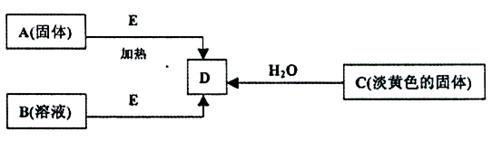
(1)B的化学式?
(2)利用下图所示的实验装置进行C与水的反应,回答下列有关同题:

①?固体C与水反应生成D的化学方程式为:?.
②?检验导管出口气体的方法为:?.
③烧杯中的现象为:?.
(3)在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X.为检验X的性质,设计如下图所示实验装置:
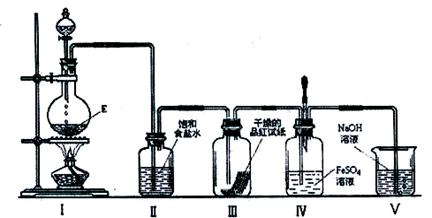
①实验过程中,观察到装置Ⅲ中的品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象.为了达到这一预期现象,你认为应该如何改进?
?。
②实验结束后,装置Ⅳ中可观察到现象是 ,若滴加两滴胶头滴管中的试剂,观察到溶液呈血红色,有关的离子方程式为:
?, 。
③X是一种重要的化工原料,用化学方程式表示X在化工生产上的一项用途:
??。
参考答案:(每空2分,共18分)(1)H2O2
(2)?①2Na2O2 + 2H2O =" 4NaOH" + O2↑②用带火星的木条靠近导管出口,观察木条是否复燃。
(或“用排水集气法收集一试管气体,用带火星的木条伸入试管中,观察木条是否复燃。”)
③出现浑浊(或“产生白色沉淀”)(3) ①在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶;②溶液由浅绿色变为黄色2Fe2+ + Cl2 = 2Fe3+ + 2Cl-、Fe3+ + 3SCN- = Fe(SCN)3?(其他合理的写法均可)
③H2+Cl2 2HCl(写“光照”不得分)或2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O或CH2=CH2+Cl2
2HCl(写“光照”不得分)或2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O或CH2=CH2+Cl2 CH2Cl—CH2Cl?(其他合理答案均可)
CH2Cl—CH2Cl?(其他合理答案均可)
本题解析:C是淡黄色固体,则C是过氧化钠,所以D是氧气。因此A是氯酸钾,E是二氧化锰,B是双氧水。
(1)双氧水的化学式为H2O2。
(2)①过氧化钠和水反应的方程式为2Na2O2 + 2H2O =" 4NaOH" + O2↑。
②检验氧气可以用带火星的木条靠近导管出口,观察木条是否复燃。
③过氧化钠和水反应是放热反应,溶液中OH-浓度增大,且氢氧化钙的溶解度降低,所以会析出晶体、
(3)①C是浓盐酸和二氧化锰反应生成氯气。由于起漂白作用的是次氯酸,所以要观察到“无明显变化”这一预期现象,需要除去氯气中混有的水蒸气,因此在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶。
②氯气具有氧化性,能氧化硫酸亚铁,生成硫酸铁,所以溶液由浅绿色变为黄色。方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl-。铁离子没和KSCN溶液反应,用来检验铁离子,方程式为Fe3+ + 3SCN- = Fe(SCN)3。
③氯气可以用来制取盐酸、漂白粉等。
本题难度:一般