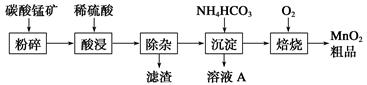
1、填空题 工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Pb(OH)2
| Mn(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
| 8.0
| 8.3
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
| 8.8
| 9.8
|
?
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。
参考答案:(1)增大接触面积,加快反应速率(使反应更充分)
(2)①2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
②除去Fe3+、Al3+ ③Ca2+
(3)(NH4)2SO4
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O
本题解析:(1)将碳酸锰矿粉碎,可以增大与H2SO4的接触面积,加快化学反应速率。(2)根据沉淀时的pH值,应把Fe2+氧化;加入CaO和H+反应,增大pH到5.2~6.0可使Al3+、Fe3+完全转化为Al(OH)3、Fe(OH)3沉淀,除去Fe3+、Al3+;调节pH值时,加入了CaO,为了除去Ca2+,应加入NaF,使之生成CaF2沉淀。
(3)溶液A中的阴离子为SO42—,所以加NH4HCO3后,生成的主要物质是(NH4)2SO4,作为氮肥用。
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O (用倒配法配平,Mn3O4中Mn的化合价为+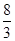 )。
)。
本题难度:困难
2、选择题 下列实验操作与预期目的或所得结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论
A
向溶液X?中加入稀盐酸和氯化钡的混合溶液,出现白色沉淀
说明溶液X?中一定含有SO42-
B
向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和NaOH溶液洗涤、分液
得到较纯净的乙酸乙酯
C
向浓度均为0.1mol?L-1?NaCl?和NaI?混合溶液中滴加少量AgNO3?溶液,出现黄色沉淀
说明Ksp(AgCl)>Ksp(AgI)
D
向盛有Fe(NO3)2溶液的试管中加入
1mol?L-1?的H2SO4
若试管口出现红棕色气体,说明NO3-被Fe2+还原为NO2
|
A.A
B.B
C.C
D.D
参考答案:A.确定其中是否含有SO42-,先加入HCl溶液,如果无明显现象,说明不含有Ag+,并且排除SO32-、CO32-等离子的影响,再加入BaCl2,如果产生白色沉淀则有SO42-,向溶液X?中加入稀盐酸和氯化钡的混合溶液,不能排除Ag+的影响,可能生成AgCl沉淀,故A错误;
B.乙酸乙酯在氢氧化钠溶液中完全水解,反应方程式为CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH,要得到较纯净的乙酸乙酯,应将乙酸乙酯不溶于饱和碳酸钠溶液,乙酸的酸性比碳酸强,能与碳酸钠反应生成二氧化碳而被吸收,然后分液可得到纯净的乙酸乙酯,故B错误;
C.向AgCl沉淀中滴加KI溶液,白色沉淀转化为黄色沉淀.说明相同体积的溶液中溶解的氯化银的物质的量多,溶解碘化银的物质的量少,即Ksp(AgCl)<Ksp(AgI),所以向浓度均为0.1mol?L-1?NaCl?和NaI?混合溶液中滴加少量AgNO3?溶液,因Ksp(AgCl)<Ksp(AgI),出现黄色沉淀,故C正确;
D.在酸性条件下,Fe2+与NO3-发生氧化还原反应,3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,对于该反应Fe2+为还原剂,NO3-为氧化剂,被还原成NO,试管口出现红棕色气体,为一氧化氮与氧气反应生成红棕色的二氧化氮,故D错误;
故选:C.
本题解析:
本题难度:简单
3、选择题 在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
参考答案:D
本题解析:对于组成相似的难溶解电解质,Ksp越大,其溶解性越大,CuS的溶解小于ZnS,A错;饱和CuS溶液中,Cu2+的浓度是Ksp1/2=(1.3×10-36)1/2,B错;相同条件下,加入S2-离子,Ksp小的先沉淀,所以Zn2+先沉淀,C错;加入FeS,可以转化为Ksp小的CuS,D正确。答案选D。
本题难度:一般
4、选择题 已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( ? )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+) 大
大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
参考答案:B
本题解析:略
本题难度:一般
5、选择题 常温下,CaSO4?在水中的沉淀溶解平衡曲线如图所示,已知 Ksp(CaSO4)=9×10-6。下列说法正确的是(?)

A.a点对应的KSP小于c点对应的KSP
B.a点变为b点将有沉淀生成
C.加入蒸馏水可以使c点变为d点
D.含有大量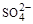 的溶液中肯定不存在Ca2+
的溶液中肯定不存在Ca2+
参考答案:B
本题解析:A、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故A错误;
B、硫酸钙溶液中存在着溶解平衡,a点在平衡曲线上增大c(SO42-),平衡左移,将有沉淀生成,故B正确;
C、d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,故C错误;
D、硫酸钙溶液中存在着溶解平衡, SO42-、Ba2+溶液中都有,故D错误。
故选B。
点评:本题考查沉淀溶解平衡,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念。
本题难度:一般