1、填空题 同温同压下,SO2与氦气的密度之比为______;若质量相同,两种气体的体积比为______.
参考答案:相同条件下,密度之比等于摩尔质量之比,故SO2与氦气的密度之比=64g/mol:4g/mol=16:1;
相同条件下,质量相同,气体体积之比与摩尔质量成反比,故两种气体的体积比=4g/mol:64g/mol=1:16,
故答案为:16:1;1:16.
本题解析:
本题难度:一般
2、选择题 下列关于物质的量浓度表述中正确的是( )
A.0.3?mol?L-1?Na2SO4溶液中含有Na+和
总物质的量为0.9?mol
B.用1?L水吸收22.4?L氨气所得氨水的浓度是1?mol?L-1
C.50mL?1?mol?L-1的KCl溶液和100mL?0.25?mol?L-1MgCl2溶液中,Cl-的物质的量浓度相等
D.10℃时0.35?mol?L-1的KCl饱和溶液100?mL,蒸发掉5?g水,再冷却到10℃时,它的物质的量浓度仍为0.35?mol?L-1
参考答案:A、溶液中含有Na+和SO2-4总物质的量与溶液体积有关,溶液的体积未知,离子的物质的量不一定,若溶液为1L,0.3?mol?L-1?Na2SO4溶液中含有Na+和SO2-4总物质的量为0.9mol,故A错误;
B、溶液的体积不是1L,氨气所处的状态未定,氨气的物质的量不一定是1mol,所得氨水的浓度不一定是1?mol?L-1,故B错误;
C、1?mol?L-1的KCl溶液中Cl-的物质的量浓度为1mol/L,0.25?mol?L-1MgCl2溶液中Cl-的物质的量浓度为0.5mol/L,Cl-的物质的量浓度不相等,故C错误;
D、10℃KCl饱和溶液100?mL,蒸发掉5g水,再冷却到10℃时,溶液仍是饱和溶液,温度相同溶解度相同,溶液的浓度相同仍是物质的量浓度仍为0.35?mol/L,故D正确.
故选:D.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是(?)
A.1mol氧原子的质量就是氧的相对原子质量
B.气体摩尔体积是指1mol任何气体所占的体积都约为22.4L
C.1mol硫酸钠中含有2×6.02×1023个钠离子
D.常温常压下,1 mol SO2的体 积为22.4 L
积为22.4 L
参考答案:C
本题解析:略
本题难度:简单
4、选择题 用 表示阿伏加德罗常数,下列结论能够成立的是
表示阿伏加德罗常数,下列结论能够成立的是
A.2L0.1mol·L-1的NaCO3。溶液中含有CO2- 3的个数是0.2
B.1 molFe与足量稀硝酸完全反应转移的电子数为2 。
。
C.0.2mol·L-1 CuSO4溶液加水稀释至体积增加l倍,其浓度变为0.1mol·L-1
D.常温下pH=5的H2SO3。水溶液中,c(H+): c(SO2- 3)=2:1
参考答案:C
本题解析: A、溶液中CO2- 3发生水解,CO2- 3的个数小于0.2 ,错误; B、1 molFe与足量稀硝酸完全反应,生成硝酸铁,转移的电子数为3
,错误; B、1 molFe与足量稀硝酸完全反应,生成硝酸铁,转移的电子数为3 ,错误;C、根据物质的量浓度计算公式,正确; D、由于分两步电离H2SO3
,错误;C、根据物质的量浓度计算公式,正确; D、由于分两步电离H2SO3 H++HSO
H++HSO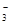 ? HSO
? HSO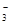
 H++SO
H++SO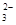 ,每出现1个SO
,每出现1个SO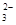 必同时有2个H+,但出现1个HSO
必同时有2个H+,但出现1个HSO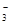 同时有1个H+,所以c(H+): c(SO2- 3)不等于2:1,错误。
同时有1个H+,所以c(H+): c(SO2- 3)不等于2:1,错误。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O含有的分子数为1 NA
B.常温常压下,53.0g Na2CO3含有的Na+离子数为1NA
C.通常状况下,44.0 g CO2分子占有的体积为22.4L
D.含有1mol MgCl2的溶液中,含有Cl—个数为1 NA