1、选择题 下列各组中的性质比较,不正确的是(?)
A.稳定性:NH3<PH3<SiH4
B.酸性:HClO4>H2SO4>H3PO4
C.碱性:KOH>NaOH>Mg(OH)2
D.还原性:F-<Cl-<Br-
参考答案:A
本题解析:由于非金属性N>P>Si,则稳定性NH3>PH3>SiH4,故A错误。由于非金属性Cl>S>P,则酸性HClO4>H2SO4>H3PO4,故B正确。由于金属性K>Na>Mg,则碱性KOH>NaOH>Mg(OH)2,故C正确。由于单质的氧化性F2>Cl2>Br2,则还原性F-<Cl-<Br-,故D正确。
本题难度:一般
2、填空题 用于金属焊接的某种焊条,其药皮由大理石、硅酸盐、硅铁等配制而成。根据题意回答:
1.Al原子的核外电子排布式为_____________________;Al与NaOH溶液反应的离子方程式为________________________________________________。
2.Si原子核外有?种不同能量的电子。硅铁属于合金,它的熔点比纯铁?
(填“高”、“低”或“不一定”)。
3.Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________,最不稳定的是?。
4.焊接过程中,药皮在高温下产生了熔渣和一种气体,该气体是_________,该气体在固态时属于?晶体。
参考答案:(共8分)
1、1s22s22p63s23p1(1分)? 2Al + 2OH- + 2H2O → 2AlO2- + 3H2↑(1分)
2、5(1分)?低(1分)
3、HCl(1分), HI(1分)
4、CO2(1分),分子(1分)
本题解析:2、硅的电子排布式为:1s22s22p63s23p2,故有五种能量电子。
3、Al3+与Yn-的电子数相同,说明Y元素为第二周期非金属阴离子,Y所在族的各元素的氢化物的水溶液均显酸性,说明Y只能为VIIA族F元素
4、大理石与硅酸盐类可在高温下生成CO2
本题难度:一般
3、选择题 同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是
A.非金属性A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.原子半径A>B>C
D.阴离子还原性C3->B2->A-
参考答案:C
本题解析:根据酸性强弱可推断,原子半径A<B<C,非金属性A>B>C,非金属性越强,气态氢化物越稳定,阴离子的还原性越弱。
本题难度:一般
4、选择题 短周期非金属元素X和Y能形成XY2型化合物,下列有关XY2的判断不正确的是( )
A.XY2一定是分子晶体
B.XY2的电子式可能是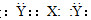
C.XY2水溶液不可能呈碱性
D.X可能是ⅣA、ⅤA或ⅥA族元素。
参考答案:A
本题解析:短周期常见由金属元素形成的XY2型化合物有很多,可结合具体例子分析,A项说法错误,XY2可能是分子晶体(CO2),也有可能是原子晶体(SiO2);如果是CO2或者CS2电子式可能是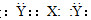 形式,B项说法正确;根据常见XY2型化合物,XY2水溶液不可能呈碱性,C项说法正确;ⅣA、VA或ⅥA族元素都有可能为+2或者+4价,所以都有可能形成XY2型化合物,D项说法也正确。
形式,B项说法正确;根据常见XY2型化合物,XY2水溶液不可能呈碱性,C项说法正确;ⅣA、VA或ⅥA族元素都有可能为+2或者+4价,所以都有可能形成XY2型化合物,D项说法也正确。
本题难度:一般
5、选择题 已知某粒子的质子数,则可确定的
A.中子数
B.最外层电子数
C.核电荷数
D.相对原子质量
参考答案:C
本题解析:质子数=核外电子数,所以已知某粒子的质子数,则可确定的是核外电子数,但其余选项不能确定,答案选C。
点评:该题是基础性知识的考查,也是高考中的常见考点。试题基础性强,主要是考查学生对原子组成以及组成微粒之间关系的熟悉了解程度,属于识记性知识的考查,难度不大,记住并能灵活运用即可。
本题难度:简单