1、选择题 关于碱金属单质的性质叙述错误的是(?)
A.在空气中燃烧都能生成过氧化物
B.都能够与水反应
C.都有较强的还原性
D.最高价氧化物对应水化物都是强碱
2、选择题 下面叙述正确的是(?)
A.同族非金属元素,自上而下所形成的酸,其酸性渐弱,因为成酸元素的非金属性渐弱
B.同族非金属的最低价阴离子,由上而下其还原性渐强,而氧化性渐弱
C.同主族元素的单质,金属则越向下熔点基本上越低,非金属则越高
D.元素周期表中Ⅲ B族的元素种类最多
3、计算题 现有0.2mol某元素 R的单质与足量的盐酸反应,在标准状况下生成6.72LH2。等量的R元素的单质与足量氧气化合,生成10.2gR元素的最高价氧化物。求R的相对原子质量及在元素周期表中的位置。
R的单质与足量的盐酸反应,在标准状况下生成6.72LH2。等量的R元素的单质与足量氧气化合,生成10.2gR元素的最高价氧化物。求R的相对原子质量及在元素周期表中的位置。
4、填空题 (19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有?。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为?,E的基态电子排布式为?,E3+与E2+的稳定性大小为?。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为?,电负性由小到大的顺序为?。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的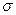 键和
键和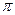 键的数目之比为?;F、G对应的氢化物中键能大小为F—H键?G—H键。
键的数目之比为?;F、G对应的氢化物中键能大小为F—H键?G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为?,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为?。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱?。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为?,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为?。
5、填空题 下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
| ?
|
③
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ④
| ?
| ?
| ⑤
| ⑥
| ?
|
(1)②元素在周期表中的位置是第二周期?族
(2)写出①的最高价氧化物的电子式?
(3)⑤和⑥两种元素的最高价氧化物对应水化物中酸性较强的是?(填化学式)
(4)写出④的单质和③的最高价氧化物的水化物反应?