1、选择题 下列离子的检验方法合理的是(?)
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
参考答案:C
本题解析:A不正确,只能说明含有铁离子,但不能排除亚铁离子;B不正确,也可能含有铁离子;D不正确,不能排除镁离子,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型,试题基础性强,难易适中。该类试题学生需要明确的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单
2、选择题 下列离子方程式正确的是
A.为了提取镁,在海水中加入熟石灰:MgSO4+2OH-=SO42-+Mg(OH)2
B.水杨酸()与足量的Na2CO3溶液混合:
C.在银氨溶液中滴加过量氢溴酸:[Ag(NH3)2]++OH-+3H++Br-=AgBr↓+2NH4++H2O
D.当钢铁处于酸性很弱或中性环境中发生吸氧腐蚀,正极反应:4H++O2+4e-=2H2O
参考答案:C
本题解析:分析:A.硫酸镁能完全电离;
B.酚-OH也能与碳酸钠反应;
C.反应生成AgBr;
D.钢铁处于酸性很弱或中性环境中发生析氢腐蚀.
解答:A.提取镁,在海水中加入熟石灰的离子反应为:Mg2++SO42-+Ca(OH)2=CaSO4↓+Mg(OH)2↓,故A错误;
B.水杨酸(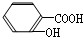 )与足量的Na2CO3溶液混合,-COOH与酚-OH均与碳酸钠反应,故B错误;
)与足量的Na2CO3溶液混合,-COOH与酚-OH均与碳酸钠反应,故B错误;
C.在银氨溶液中滴加过量氢溴酸的离子反应为[Ag(NH3)2]++OH-+3H++Br-=AgBr↓+2NH4++H2O,故C正确;
D.当钢铁处于酸性很弱或中性环境中发生析氢腐蚀,正极反应:2H++2e-=H2,↑,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意选项B为解答的易错点,题目难度中等.
本题难度:一般
3、选择题 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2 体积(V)的关系如图,图中AB段表示的先后离子方程式是

[? ]
①CO2+OH-=HCO3- ②CO2+2OH-=CO32-+ H2O ③CO32-+Ba2+=BaCO3↓
④BaCO3+CO2+H2O=Ba2++2HCO3- ⑤CO32-+CO2+H2O=2HCO3-
A.②⑤
B.⑤④
C.④②
D.④①
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列离子方程式书写正确的是
A.将少量SO2通入漂白粉溶液中:CaSO3↓+2HClO
B.CuSO4溶液与少量Ba(OH)2溶液反应:+Cu(OH)2↓
C.Fe2O3与氢碘酸反应:
D.向双氧水中滴加少量酸性高锰酸钾溶液,溶液的紫红色褪去:
参考答案:B
本题解析:分析:A、次氯酸具有强氧化性,亚硫酸钙被氧化为硫酸钙;
B、硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀;
C、三价铁离子具有氧化性,氧化碘离子为碘单质;
D、原子不守恒.
解答:A、次氯酸具有强氧化性,亚硫酸钙被氧化为硫酸钙,将少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++3ClO-=CaSO4↓+2HClO+Cl-,故A错误;
B、硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故B正确;
C、Fe2O3具有氧化性,I-具有还原性,二者会发生氧化还原反应,离子方程式为Fe2O3+6H++2I-=2Fe3++I2+3H2O,故C错误;
D、选项中原子不守恒,离子方程式为:20H-+2MnO4-+5H2O2=2Mn2++5O2↑+10H2O,故D错误;
故选B.
点评:本题考查离子方程式正误判断和书写方法,注意氧化性离子和还原性离子的分析,题目难度中等.
本题难度:困难
5、填空题 某溶液中可能含有Na+、K+、Br-、SO42-、CO32-等离子中的全部或其中的几种,现进行以下的连续操作:a.用洁净铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;b.溶液中通入氯气,溶液由无色变为红棕色;c.溶液中加入过量的稀硫酸后,无气体放出;再加Ba(OH)2溶液后,产生白色沉淀。试填写下列空白:
⑴原混合液中一定存在的离子是______________,一定不存在的离子是_____________
⑵上述a—c的操作中,______是错误的,理由是______________________________。
⑶为确定另一种金属离子是否存在,应补充的操作是__________________。
参考答案:(1)Na+、Br-,CO32-;
(2)C;若将加入过量的稀硫酸改为加入过量的稀盐酸,便可以根据加入Ba(OH)2是否产生白色沉淀确定SO42-的存在;
(3)过蓝色钴玻璃做焰色反应。
本题解析:焰色反应为黄色,则溶液中一定有Na+,通入氯气溶液由无色变成红棕色,则溶液中一定有Br-,溶液中加入过量的稀硫酸后,无气体放出,则一定没有CO32-,再加Ba(OH)2溶液后,产生白色沉淀,不能确定溶液中是否有SO42-。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般