1、选择题 在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
[? ]
A. Z为 0. 3mol/L
B. Y2为 0. 4mol/L
C. X2为 0. 2mol/L
D. Z为 0. 4mol/L
参考答案:A
本题解析:
本题难度:一般
2、填空题 (3分) 在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K=?。
(2)该反应为?反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ?℃。
参考答案:

本题解析:略
本题难度:一般
3、选择题 反应CO+H2O(g) CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是(?)
CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是(?)
A.增大水蒸气的浓度
B.将压强减小至原来的一半
C.添加催化剂
D.将反应温度升高至1200 K
参考答案:D
本题解析:化学平衡常数只与温度和化学方程式中的化学计量数有关系,对于具体的化学反应,只要温度不变,平衡常数就是不变的,所以A、B、C中平衡常数不变。D中温度改变,平衡常数一定发生变化,答案选D。
点评:该题是基础性试题的考查,也是高考中常见考点之一,需要学生重点掌握。该题基础性强,难度不大,学生只要记住影响平衡常数的外界条件即可得出正确的结论。
本题难度:一般
4、计算题 在一定条件下,将物质的量之比为1∶3的N2和H2?102g通入密闭容器中,达到平衡后,测知混合气体的平均相对分子质量为12.5。求混合气体中NH3的质量?
参考答案:32.64g
本题解析:设N2的物质的量为x,则H2的物质的量是3x,由题意知,28g/mol×x+2g/mol×3x=102g,解之,得:x=3mol。又由:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
n(开始)/mol: 3? 9? 0
n(转化)/mol:? a? 3a? 2a?
n(平衡)/mol: 3-a? 9-3a?2a
(3-a)+(9-3a)+2a= =8.16mol
=8.16mol
解之,得:a=1.92mol。
则混合气体中NH3的质量为:2×1.92mol×17g/mol=32.64
本题难度:简单
5、选择题 将a L NH3通入某恒压的密闭容器中,在一定条件下让其分解,达到平衡后气体体积增大到b L(气体体积在相同条件下测定)。下列说法中正确的是( )
A.平衡后氨气的分解率为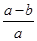 ×100%
×100%
B.平衡混合气体中H2的体积分数为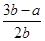 ×100%
×100%
C.反应前后气体的密度比为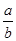
D.平衡后气体的平均摩尔质量为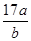 g
g
参考答案:B
本题解析:设分解的NH3为x L,则
2NH3(g) N2(g)+3H2(g)
N2(g)+3H2(g)
起始体积(L):? a?0?0
转化体积(L):? x? ?
?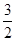 x
x
平衡体积(L):? a-x? ?
?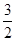 x
x
根据题中信息可知,a-x+ +
+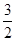 x=b,即x=b-a,平衡后NH3的分解率为
x=b,即x=b-a,平衡后NH3的分解率为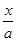 ×100%=
×100%= ×100%A项错误;平衡混合气体中H2的体积分数为
×100%A项错误;平衡混合气体中H2的体积分数为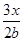 ×100%=
×100%=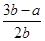 ×100%,B项正确;由于反应前后气体的质量(设为m g)不变,再根据密度的定义可得反应前后气体的密度之比为
×100%,B项正确;由于反应前后气体的质量(设为m g)不变,再根据密度的定义可得反应前后气体的密度之比为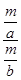 =
=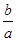 ,C项错误;摩尔质量的单位为g/mol,D项错误。
,C项错误;摩尔质量的单位为g/mol,D项错误。
本题难度:一般