| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《反应速率与平衡的有关计算》试题强化练习(2017年最新版)(八)
 2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。 2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。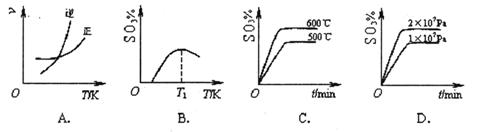 (3)某温度下SO2(g)+  O2(g) O2(g)  SO3(g) ΔH=-98KJ/mol SO3(g) ΔH=-98KJ/mol①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______ ②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________ (4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________ 参考答案:(12分) 本题解析: 本题难度:一般 4、填空题 (12分)现有反应:CO(g)+ H2O(g) 参考答案:(12分)(每空3分)(1) <? (2) ①逆反应?② 0≤x<3? (3) < 本题解析:(1)正反应是放热反应,所以升高温度,平衡向逆反应方向移动,平衡常数减小。 本题难度:一般 5、填空题 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值?(填“一定增大”、“一定减小”或“可能增大也可能减小”)。 参考答案:(1)可能增大也可能减小 本题解析:(1)化学平衡常数与温度有关,若正反应为吸热反应,升高温度,平衡常数增大;若正反应为放热反应,升高温度,平衡常数减小,所以温度升高,K值可能增大,也可能减小。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的量》.. | |