1、选择题 在一定的温度和容积为l L的密闭容器中投入A 、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是

A.t1时刻之后,若再加入一定量的A,达平衡时A的转化率降低
B.t1时刻之后,3v(A)逆=2v(C)正 (v —速率)
C.t1时刻之后,若升高温度,混合气体的平均摩尔质量增大,则该反应A消耗的方向为吸热反应
D.在温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时A的体积分数为3/7
参考答案:C
本题解析:该反应的方程式为:2A?B+3C;A正确,t1时刻之后,若再加入一定量的A,相当于增大了压强,平衡向逆反应方向移动,即达平衡时A的转化率降低;
B正确,t1时刻之后,反应已达平衡状态,即正、逆反应速率之比=化学计量数之比,即3v(A)逆=2v(C)正;
C错,t1时刻之后,若升高温度,混合气体的平均摩尔质量增大,由于反应物和生成物均为气体,即体系总质量不变,所以混合气体的总物质的量减小,即可得平衡向逆反应方向移动,得正反应的方向为放热反应;
D正确,温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时与起始时投入2molA互为等效平衡;
本题难度:一般
2、填空题 已知NO2和N2O4可以相互转化: N2O4  ?2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
?2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为?mol/L·s
(2)在4s时容器内的压强为开始时的?倍
(3)在平衡时容器内含N2O4?mol
(4)在平衡时容器内NO2的浓度为?mol/L
(5)平衡时N2O4的转化率为??
参考答案:(1)0.005mol/(L·s)(2)1.2倍(3)0.2mol(4)0.16mol/L (5)80%
本题解析:N2O4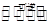 2 NO2
2 NO2
(1)反应进行4s时NO2的浓度为0.04mol/L;则v(NO2)="0.04mol/L" / 4s="0.04mol/(L·s)" ;v(N2O4)/v(NO2)=1/2,故前4秒以N2O4浓度变化表示的平均反应速率为0.005mol/(L·s)
(2)等温等容,压强与气体的物质的量成正比。则4秒时,n(NO2)="0.04mol/L" * 10L = 0.4mol
参加反应的N2O4为0.2mol,则此时容器内气体总物质的量为1mol-0.2mol+0.4mol=1.2mol,起始是容器中只有1mol N2O4气体,则在4s时容器内的压强为开始时的1.2倍;
(3)平衡时压强为开始的1.8倍,则平衡时容器内气体物质的量为1.8mol,设参加反应的N2O4为x,则有(1-x)+2x=1.8?解得:x=0.8mol,则在平衡时容器内含N2O4?的物质的量为:1mol-0.8mol=0.2mol;
(4)由于在平衡时容器内含N2O4?0.8mol,故此时容器内NO2的浓度为(0.8*2)/10 mol/L =0.16mol/L,则在平衡时容器内NO2的浓度为0.16mol/L;
(5)平衡时消耗的N2O4物质的量为:0.8mol ,则平衡时N2O4的转化率为:0.8mol/1mol=80% ;
点评:化学反应速率为高考重要考点之一,基础演算能力的要求较高,而且全面要求考生对可逆反应、化学反应速率等相关知识的理解与熟练掌握,具有一定的分析力度与考查难度,考生平时应当多注重化学反应速率相关内容的实践练习。
本题难度:一般
3、选择题 已知,I2(aq)+I-(aq) I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是
I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是
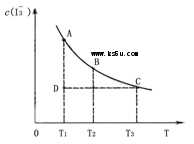
A.反应 I2(aq)+I-(aq)  I3-(aq)的△H>0
I3-(aq)的△H>0
B.状态A的c(I2)比状态D的小
C.A点对应的反应速率大于C点对应的反应速率
D.其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点
参考答案:B
本题解析:
正确答案:B
A、不正确,从图得出,温度升高,I3―浓度变小,平衡逆向移动,△H小于0;
B.正确;
C.不正确,A点对应的反应速率不于C点对应的反应速率,A点温度低;
D.不正确,其他条件不变,向溶液中加入KI固体,不衡正向移动,平衡由C点移动到A点;
本题难度:一般
4、选择题 某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) 2Z(g)+W(s),下列叙述中正确的是
2Z(g)+W(s),下列叙述中正确的是
A.达到平衡后,增加W的量,X的转化率下降
B.当容器中气体压强不变时,反应达到平衡
C.若升高温度,测得平衡常数增大,则该反应为吸热反应
D.反应过程中,气体的密度始终不变
参考答案:C
本题解析:W是固体,达到平衡后,增加W的量,对平衡移动无影响,A错误;W是固体,反应前后气体物质的量不变,无论平衡态还是非平衡态,容器中气体压强不变,B错误;平衡常数增大,说明平衡向右移动,升高温度,平衡向吸热反应方向移动,C正确;W是固体,反应前后气体质量不守恒,而气体的体积不变,所以反应过程中气体的密度减小至平衡时不变,D错误。
点评:可逆反应达到平衡时,增加固体或纯液体的量,平衡不移动;若反应中不全是气体,反应在容积固定的容积中进行,则气体的密度不变的状态为平衡状态。
本题难度:一般
5、选择题 如图是表示:2X (g)+Y (g) ?Z (g)+R (g)?⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
?Z (g)+R (g)?⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是

A.减少Z物质
B.加大压强
C.升高温度
D.使用催化剂
参考答案:D
本题解析:由图可以看出,t1时改变条件,反应速率增大,而平衡不移动。减少Z物质,v减小,平衡右移,A错;加大压强,v增大,平衡右移,B错;升高温度,v增大,平衡左移,C错;使用催化剂,能同等程度的增大正逆反应速率,平衡不移动,选D。
点评:化学平衡图像是化学平衡的一个重要知识点,历年高考经常考查,考生在备考过程中应学会分析图像。
本题难度:一般