1、选择题 可逆反应mA(g)+nB pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
2、填空题 (16分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)?△H=-49.0kJ/mol
CH3OH(g)+H2O(g)?△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
 ?
?
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率为?。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升 高温度? B.充入He(g),使体系压强增大
高温度? B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离? D.再充入1mol CO2和3mol H2
⑵工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的
CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的 同时不断充入氢气,使H2的浓度保持不变,则平衡?;
同时不断充入氢气,使H2的浓度保持不变,则平衡?;
A.向正反应方向移动? B.向逆反应方向移动
C.不移动? D.无法判断
作出此判断的理由是??。
3、选择题 反应:A(g)+3B(g) 2C(g);ΔH<0,达平衡后,将气体温度降低,下列叙述中正确的是(?)
2C(g);ΔH<0,达平衡后,将气体温度降低,下列叙述中正确的是(?)
A.v(正)加大,v(逆)减小,平衡右移
B.v(正)、v(逆)都减小,平衡右移
C.v(正)、v(逆)都加大,平衡左移
D.v(正)、v(逆)都减小,平衡左移
4、填空题 (9分) 在一定体积的密闭容器中,进行如下可逆化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K=?;
(2)能判断该反应是否达到化学平衡状态的依据是?(多选扣分)。
A.容器中压强不变? B.混合气体中 c(CO)不变
C.V正(H2O)= V逆(H2O)? D.c(CO2)= c(CO)
(3) 800℃时,反应CO(g)+H2O(g) ? CO2(g)+H2(g)的平衡常数K=?。
? CO2(g)+H2(g)的平衡常数K=?。
5、计算题 在2L容器中,放入0.4molA和0.6molB,在一定温度下,压强为P,发生反应:2A(g)+3B(g)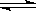 x C(g)+2D(g),在10min后,容器中c(A)="0.1" mol·L-1
x C(g)+2D(g),在10min后,容器中c(A)="0.1" mol·L-1
(1)若温度与压强均未改变,求v(B)
(2)若温度不变,压强变为0.9P,求n(D)和x 的值