1、选择题 不符合原子核外电子排布基本规律的是?
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
参考答案:D
本题解析:A.核外电子总是首先排布在离核近、能量低的电子层上,故A正确;
B.K层离原子核最近,能量最低,故B正确;
C.N层最多可以排布2×42个电子,为最外层是最多排8个,为次外层时最多排18个,故C正确;
D.各电子层(n)最多可容纳的电子数为2n2故D错误;
故选A。
点评:本题考查了原子核外电子排布的规律,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:一般
2、选择题 下列晶体直接由原子构成的有?
[? ]
A.硫磺?
B.石英晶体?
C.晶体硅?
D.金属铝
参考答案:BC
本题解析:
本题难度:简单
3、选择题 下列说法中错误的是
A.键长愈长,化学键愈不牢固
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.原子及其离子的核外电子层数均等于该元素所在的周期数
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是?
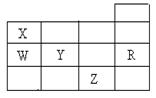 ?
?
A.X、Y、Z的阴离子电子层结构均与R原子的相同
B.常压下,Y单质的沸点比Z单质的沸点高
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.最高价氧化物的水化物酸性W比Y强
参考答案:B
本题解析:根据元素在周期表中的位置可知,R、W、X、Y、Z五种元素分别是Ar、P、N、S、Br。A不正确,只有Y的阴离子电子层结构均与R原子的相同。常温下硫是固体,单质溴是液体,B正确。同主族自上而下非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,C不正确。同周期自左向右非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,D不正确。答案选B。
本题难度:简单
5、选择题 研究下表信息可直接得出的结论是
元素
| F
| Cl
| Br
| I
|
氢化物组成
| HF
| HCl
| HBr
| HI
|
氢化物形成难易程度
| H2、F2混合,冷暗处剧烈化合并发生爆炸
| H2、Cl2混合,光照或点燃时发生爆炸
| H2与Br2混合,加热发生化合
| H2、I2混合,加热化合,同时又分解
|
氢化物热稳定性
| 很稳定
| 稳定
| 较稳定
| 较不稳定
A.元素性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数递增而增强

C.第VII A族元素的金属性随电子层数增加而减弱
D.第VIIA族元素的非金属性随电子层数的增加而减弱
|
题型:单选题难度:中档来源:不详 答案 马上分享给同学