1、填空题 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请回答:
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ⑤
| ?
| ⑥
| ?
| ?
|
3
| ①
| ③
| ④
| ?
| ?
| ?
| ⑦
| ⑨
|
4
| ②
| ?
| ?
| ?
| ?
| ?
| ⑧
| ?
|
(1)这九种元素中(填元素符号)⑤是?,其中化学性质最不活泼的是?。
⑤和⑥形成化合物的电子式?
(2)在这些元素的最高价氧化物对应的水化物中,碱性最强的是(填化学式)。?
酸性最强的是?呈两性的是?,写出三者之间相互反应的化学方程式??;
?
?
(3)①、②、③三种元素按原子半径由大到小的顺序依次为?(填元素符号)。
(4) 用电子式表示⑧元素与③元素形成化合物的过程?。
(5) 在①和②中化学性质最活泼的是?
(6)在⑦和⑧中化学性质最活泼的是?,用化学实验证明的方法和离子方程式:
方法?
离子方程式??
参考答案:(1)C? Ar?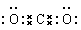
(2) KOH? HClO4? Al(OH)3? KOH +HClO4=KClO4 +H2O? KOH + Al(OH)3=KAlO2 +2H2O
(3) K>Na>Mg? (4)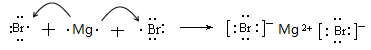 (5)K?
(5)K?
(6)? Cl?取适量溴化钠溶液滴入氯水,溶液变为橙黄色,则非金属性Cl>Br? Cl2 + 2Br-= 2Cl- + Br2
本题解析:(1)根据元素在周期表中的相对位置可知①~⑨九种元素分别是Na、K、Mg、Al、C、O、Cl、Br、Ar。Ar是稀有气体元素,化学性质最不活泼。⑤和⑥形成化合物是CO2,含有共价键的共价化合物,其电子式是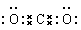 。
。
(2)金属性或非金属性越强,最高价氧化物的水化物的碱性或酸性越强,则KOH的碱性最强,HClO4的酸性最强, Al(OH)3是两性氢氧化物。
(3)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则三种元素的原子半径大小顺序是K>Na>Mg。
(4)示⑧元素与③元素形成化合物是溴化镁,含有离子键,其形成过程可表示为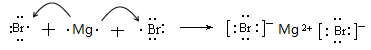 。
。
(5)同主族自上而下,金属性逐渐增强,所以K的金属性强于Na的金属性。
(6)同主族自上而下,非金属性逐渐减弱,所以Cl的非金属性强于Br的非金属性。可根据非金属性强的单质转换弱,即取适量溴化钠溶液滴入氯水,溶液变为橙黄色,则非金属性Cl>Br,所以的离子方程式是Cl2 + 2Br-=2Cl- + Br2。
点评:该题是基础性试题的考查,侧重对学生基础知识巩固和训练的同时,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:一般
2、填空题 X、Y、Z为三种短周期元素,他们在周期表中的位置关系如图所示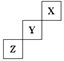 。据此回答下列问题:
。据此回答下列问题:
(1)X元素的名称为?,它形成的单质为?(用分子式表示); He?。若该元素的某种原子内核内中子数与质子数相等,则该原子的摩尔质量是??;结合最近卫星发回的图片预测,月球的土壤中吸附着数百万吨的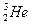 ,上述原子与
,上述原子与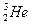 的关系是??。
的关系是??。
(2)Y元素形成单质的电子式是?,Y单质的氧化性?(填“强于”或者“弱于”)O2的氧化性,并用相应的化学方程式说明?。
(3)元素Z在自然界中的存在形态为?(填序号)①只有化合态,②只有游离态,③既有游离态,又有化合态;含Z元素的某些化合物燃烧后会造成严重的大气污染,其主要原因是?。
(4)Y元素、Z元素与H2化合时的能量变化是?,(填“都放热”、“都吸热”、“前者放热,后者吸热”或者“前者吸热,后者放热”),能量变化的大小关系为前者?(填“>”、“=”或者“<”)。
参考答案:(1)氦,He ,4g/mol ,同位素;(每空1分)(2) ?(1分),强于(1分),2F2 + 2H2O =" 4HF" + O2↑(2分)(3)③(1分),含S的某些化合物燃烧后生成SO2,会形成酸雨,危害环境(2分)。?(4)都放热,>(每空1分)。
?(1分),强于(1分),2F2 + 2H2O =" 4HF" + O2↑(2分)(3)③(1分),含S的某些化合物燃烧后生成SO2,会形成酸雨,危害环境(2分)。?(4)都放热,>(每空1分)。
本题解析:符合如图所示位置的短周期元素,易判断出X、Y、Z分别为 He 、F、S。He只能形成单原子分子,质子数相同、中子数不同的两种原子互为同位素,火山口附近存在单质S,S元素燃烧后生成污染性气体SO2;元素的非金属性越强,生成的氢化物越稳定,放出的能量越多。
本题难度:简单
3、选择题 短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。则下列说法正确的是
A.B与A只能形成化合物BA3?
B.C的原子半径、离子半径均分别小于D的原子半径、离子半径
C.A、B、C形成的化合物可能促进水的电离,也可能抑制水的电离?
D.A、D均能与C形成原子个数比为1︰1、2︰1的化合物,且A2C2与D2C2的化学键类型相同
参考答案:C
本题解析:因C和E同主族,存在C2-,故C是O、E是S;C2-与D+的核外电子数相等,D是Na;A和D同主族,A为非金属元素,A是H;A与B的原子序数之和等于C的原子序数,B是N。A.B与A形成化合物NH3、N2H4等;B.Na的原子半径大于O、Na+离子半径小于O2-半径;C.A、B、C形成的化合物为HNO3或HNO2能促进水的电离,NH4NO3或NH4NO2能抑制水的电离;D.H2O2化学键类型是极性键和非极性键、Na2O2的化学键类型是离子键和非极性键。
本题难度:一般
4、选择题 以下集气装置中正确的是 ?
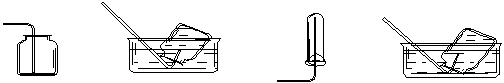
A.CO2的收集
B.NO的收集
C.O2的收集
D.NH3的收集
参考答案:AB
本题解析:试题分析:CO2的密度大于空气的,所以应该用向上排空气法收集,A正确;NO极易被氧化生成NO2,所以只能用排水法收集,B正确;O2的密度大于空气的,所以应该用向上排空气法收集,C正确;氨气极易溶于水,应该用向下排空气法收集,D不正确,答案选AB。
考点:考查常见气体收集方法的判断
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:简单
5、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
|
原子半径/pm
| 160
| 143
| 70
| 66
|
主要化合价
| +2
| +3
| +5、+3、-3
| -2
|
下列叙述不正确的是
A.X、Y元素的金属性X<Y
B.X单质在空气中燃烧可以形成化合物X3Z2
C. X和Y均能与氧化物发生置换反应
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
参考答案:A
本题解析:根据元素的主要化合价和原子半径可知,X是镁,Y是Al,Z是N,W是O。同周期自左向右金属性逐渐减弱,所以金属性是镁大于铝,A不正确。镁可以在氮气中燃烧,生成氮化镁,B正确。钠和水反应,镁可以在CO2中燃烧,C不正确。氧气可以和氨气反应生成氮气,D正确。答案选A。
本题难度:一般