|
高中化学知识点总结《电解池原理》考点预测(2017年强化版)(六)
2017-11-05 23:14:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列说法正确的是
A.电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移
B.含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022
C.28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022
|
参考答案:A
本题解析:A.电解法精炼铜,阴极是铜离子放电,则当阴极质量增加32 g即0.5mol铜时,转移0.5mol×2=1mol电子,即一定有6.02×1023个电子转移,A正确;B.碳酸钠溶于水碳酸根水解生成碳酸氢根和氢氧根,则含10.6 g Na2CO3即0.1mol碳酸钠的溶液中,所含阴离子总数大于6.02×1022,B错误;C.乙烯和氮气的相对分子质量相等,都是28,则28 g由乙烯和氮气组成的混合气体的物质的量是1mol,则含有的原子个数大于2×6.02×1023,C错误;D.浓硫酸与铜反应时浓度逐渐降低,稀硫酸与铜不反应,则含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于6.02×1022,D错误,答案选A。
考点:考查阿伏加德罗常数的计算
本题难度:一般
2、简答题 用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下:
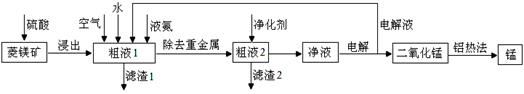
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
参考答案:(1)蒸馏
(2)空气中的氧气和氮气透过分离膜的能力不同
(3)Hg2++S2-=HgS↓
(4)Mn2++2H2O-2e-=MnO2+4H+;回收未反应的Mn2+,提高二氧化锰的产率。
(5)3MnO2+4Al 2Al2O3+3Mn 2Al2O3+3Mn
本题解析:(1)向粗液1中加入的水最后需要蒸馏达到浓缩的目的,使溶质的浓度增大。
(2)流程中用的空气是用膜分离法制备的富氧空气,其原理为空气中的氧气和氮气透过分离膜的能力不同,故答案为:空气中的氧气和氮气透过分离膜的能力不同;
(3)粗液2中发生主要反应的离子方程式为Hg2++S2-=HgS↓;
(4)净液主要含硫酸锰,电解时锰离子放电生成二氧化锰,则阳极反应式为Mn2++2H2O-2e-=MnO2+4H+;电解液循环利用是因回收未反应的Mn2+,提高二氧化锰的产率。
(5)铝热法炼锰的化学方程式为3MnO2+4Al 2Al2O3+3Mn。 2Al2O3+3Mn。
本题难度:一般
3、选择题 下列描述中,符合生产实际的是 (? )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阳极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阴极
参考答案:C
本题解析:冶炼铝用碳作阳极;精炼铜纯铜做阴极;电镀锌时,锌为镀层金属做阳极。
本题难度:一般
4、选择题 利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,
下列来源:91考试网 91EXAm.org叙述正确的是?
A.电解时可以精铜为阳极,以CuSO4溶液为电解液
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu-2e—=Cu2+
D.电解结束后,电解质溶液的浓度保持不变
参考答案:B
本题解析:A选项,点解时,粗铜为阳极。B选项,正确。C选项,粗铜连接电源正极。D选项,电解结束后电解质溶液的浓度变低。
本题难度:一般
5、填空题 (11分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,
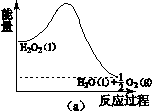
试判断该反应为 反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:
 Fe2++ Fe2++  H2O2 + H2O2 +  _________ ="=" _________ ="="  _________+ _________+  _________ _________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。 N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。

(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物。
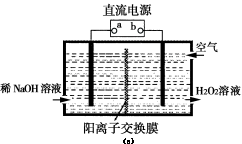
试回答:
①电源a极的名称是 。
②写出阴极电极反应式 。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
| Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
参考答案:(11分)
(1) (1分) (1分)
(2)放热 (1分)
①2 1 2H+ 2 Fe3+ 2H2O (2分)
②深 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动(2分)
(3)①正极 (1分)
②O2+2e-+2H2O=H2O2+2OH- (1分)
(4)H2O2+2H++Cu=Cu2++2H2O (1分)
温度升高H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低 (2分)
本题解析:(1)H2O2为共价化合物,电子式为 ;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g) ;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g)  N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。 N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。
考点:反应热、离子方程式、化学平衡、电化学
本题难度:困难
|