1、选择题 下列各组分子中,都属于含极性键的非极性分子的是
[? ]
A.CO2 H2S
B.C2H4 CH4
C.C60 C2H4
D.NH3 HCl
参考答案:B
本题解析:
本题难度:简单
2、选择题
表是元素周期表中短周期的一部分.已知A元素的原子中最外层电子数比其电子层数的3倍还多.下列关于表中六种元素的说法正确的是( )
A.X元素形成的气态氢化物分子空间结构呈三角锥形
B.X、Y、Z三种元素形成的单核阴离子半径中Y最大
C.最高氧化物的水化物酸性最强的是A元素
D.X的氢化物分子间含有氢键,因此X的热稳定性很大
参考答案:A元素的原子中最外层电子数比其电子层数的3倍还多,则A位于第二周期,电子层数为2,A应为F元素,则X为O元素,M为Ne元素,Y为S元素,Z为Cl元素,N为Ar元素,则
A.X为O元素,形成的气态氢化物分子空间结构呈V形,故A错误;
B.离子的核外电子层数越多,半径越大,离子核外电子排布相同时,核电核数越大,半径越小,则形成的单核阴离子半径中Y最大,故B正确;
C.A应为F元素,没有正价,不存在最高氧化物的水化物,酸性最强的应为Z元素,故C错误;
D.氢键与稳定性无关,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 下列物质的化学式,错误的是( )
A.熟石膏CaSO4?H2O
B.萤石CaF2
C.重晶石BaSO4
D.绿矾FeSO4?7H2O
参考答案:A.熟石膏的化学式是CaSO4?12H2O,生石膏的化学式是CaSO4?2H2O,故A错误;
B.萤石的化学式是CaF2,故B正确;
C.重晶石的主要成分是硫酸钡,其化学式是BaSO4,故C正确;
D.绿矾的化学式是FeSO4?7H2O,亚铁离子不稳定,易被氧化,故D正确;
故选A.
本题解析:
本题难度:一般
4、选择题 下列物质中只存在离子键的是( )
A.Cl2
B.CaCl2
C.CO2
D.NaOH
参考答案:B
本题解析:
本题难度:简单
5、简答题 A,B,C,D,E为五种短周期元素且原子序数依次增大,已知A的气体单质密度最小,B元素与其他元素形成的化合物达几千万种,C元素能与A元素形成CA3型化合物;?E元素的原子半径在短周期中半径最大;A、D、E三种元素形成的化合物甲电子总数为20,由此可知:
(1)写出元素符号:B为______,D为______.
(2)CA3的结构式:______化合物甲的电子式为______.
(3)A、B原子个数之比为1:1可组成的两种物质乙与丙,其中乙物质能使高锰酸钾溶液与溴水褪色,并在同类物质中其分子量最小;丙物质的化学键是介于单键与双键之间的一种独特的键.写出物质乙的结构简式______;物质丙与A、C、D三种元素形成的一种无机强酸反应方程式:______.
参考答案:A的气体单质密度最小,应为H元素,B元素与其他元素形成的化合物达几千万种,应为C元素,C元素与A元素形成CA3型化合物,应为N元素;E元素的原子半径在短周期中半径最大,应为Na元素;A、D、E三种元素形成的化合物甲电子总数为20,应为NaOH,则D为O元素,
即A为H,B为C,C为N,D为O,E为Na,则
(1)B为C,D为O,故答案为:C;O;?
(2)CA3为NH3,为三角锥形结构,结构式为
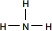
,化合物甲为NaOH,电子式为
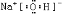
,
故答案为:
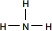
;
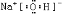
;
(3)H、C原子个数之比为1:1可组成的两种物质乙与丙,其中乙物质能使高锰酸钾溶液与溴水褪色,并在同类物质中其分子量最小,则乙为C2H2,结构式为CH≡CH,丙为苯,A、C、D三种元素形成的一种无机强酸为HNO3,二者在浓硫酸作用下反应生成硝基苯,反应历程为
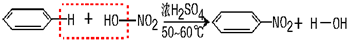
,
故答案为:CH≡CH;
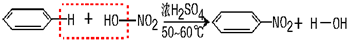
.
本题解析:
本题难度:一般