1、选择题 关于化学键的下列叙述中,正确的是
[? ]
A.离子化合物中只含离子键
B.共价化合物中只含非金属元素
C.离子化合物中可能含共价键
D.离子化合物中一定含有金属离子
参考答案:C
本题解析:
本题难度:简单
2、填空题 (4分)下面是你熟悉的物质:
①O2② 金刚石 ③ NaBr ④ H2SO4⑤ Na2CO3⑥ K2S?⑦NaHSO4
小题1:这些物质中,只含共价键的是_______________;只含离子键的是___________;既含共价键又含离子键的是_______________。
小题2:将NaHSO4溶于水,写出其电离方程式______________________________。
参考答案:
小题1:①②④? ③⑥? ⑦⑤?
小题2:NaHSO4==Na++H++SO42-
本题解析:(1)考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。所以①~⑦中含有的化学键分别为非极性键、非极性键、离子键、极性键、离子键和极性键、离子键、离子键和极性键。
(2)磷酸氢钠是电解质溶于水完全电离,电离方程式为NaHSO4==Na++H++SO42-。
本题难度:一般
3、填空题 具有光、电、磁等特殊功能的新型材料是目前化学研究的热点之一,二硫醇烯与锌的配合物(C)的一种合成途径如下。
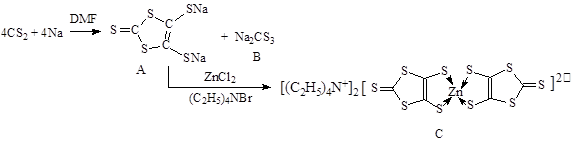
(1)锌原子基态时核外电子排布式为?。
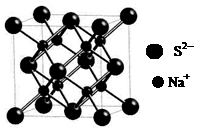
(2)下列说法正确的是?(不定项选择)。
a.金属钠的熔点比金属锂高
b.金属钠晶体属于面心立方堆积
c.CS2的沸点比CO2高
d.硫化钠晶胞(如图所示)中含4个S2-离子
(3)化合物B中CS32-的空间构型是?(用文字描述)
(4)配合物C中Zn2+的配位数是?(填数字),N原子杂化方式是?。
(5)1mol化合物A中含有σ键的数目为?。
参考答案:(1)1S22S23S23P63d64S2或[Ar]3d104S2(2)cd;?(3)平面正三角形;(4)4;SP3;8NA
本题解析:(1)锌是30号元素,原子核外有30个电子,故其原子基态时核外电子排布式为1s22s23s23p63d104s2。
(2)金属晶体溶点高低与晶格能大小相关,而晶格能与阳离子半径大小和电子数多少有关,由于锂离子半径小,两都自由电子数相同,因此钠的晶格能较上,自然熔点较低。金属钠晶体属于体心立方堆积,由于两者都是分子晶体,相对分子质量越大,分子间作用力越大,所以CS2的沸点比CO2高。d.硫化钠晶胞中S2-离子个数计算为8*1/8+6*1/2=4个,故选CD。
(3)化合物B中CS32-的空间构型是根据价层电子对互斥理论可以得出(4+2)/2=3,故为平面三角形分子。
(4)配合物C中Zn2+的配位数是4,N原子杂化方式是SP3杂化方式,与铵根离子中氮的形式一样。
(5)双键中有一个键是σ键,故1mol化合物A中含有σ键的数目为8mol。
本题难度:一般
4、填空题 如图中A、B、C、D是同周期或同主族的相邻元素:
①已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子质量数为______,原子序数为______,A元素位于第______周期______族.
②写出元素符号A:______,B:______,C:______,D:______.
③A、B、C三种元素最高价氧化物的水化物的化学式依次为______,______,______,其中酸性最强的是______.
④B、D两种元素和氢组成的气态氢化物的化学式依次为______,______其中______稳定性最大,______还原性最强.
参考答案:(1)由A元素的最低价为-3价,则最高价为+5价,它的最高价氧化物为A2O5,含氧56.34%,设相对原子质量为x,
则x×2x×2+16×5×100%=56.34%,解得x=31,
质子数等于原子序数,设原子序数为y,原子核内中子数比质子数多1个,中子数为y+1,
则y+(y+1)=31,解得y=15,即A为P元素,原子结构中有3个电子层,最外层有5个电子,
P位于元素周期表中的第三周期第ⅤA族,
故答案为:31;15;三;ⅤA;
(2)由元素在周期表中的位置可知,A、B、C同周期相邻元素,B、D为同主族元素,则B为S,C为Cl,D为O,
故答案为:P;S;Cl;O;
(3)A、B、C同周期,从左到右元素的非金属性在增强,三种元素最高价氧化物的水化物的化学式依次为H3PO4、H2SO4、
HClO4,
Cl的非金属性最强,则HClO4的酸性最强,故答案为:H3PO4;H2SO4;HClO4;HClO4;
(4)B、D同主族,气态氢化物的化学式依次为H2S、H2O,非金属性O>S,则稳定性H2O>H2S,H2S的还原性最强,
故答案为:H2S;H2O;H2O;H2S.
本题解析:
本题难度:一般
5、填空题 (15分)(物质结构与性质)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知 :
:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
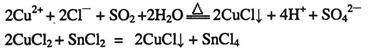
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为?。H、N、O三种元素的电负性由大到小的顺序是? ?。
?。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为
?。
(3)乙二胺分子 中氮原子轨道的杂化类型为?。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_?。
中氮原子轨道的杂化类型为?。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_?。
(4)②中所形成的配离子中含有的化学键类型有_______。(填字母)
a.配位键? b.极性键? c.离子键? d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_____。
参考答案:
(3)sp3杂化(2分),乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(2分)
( 4)abd(2分)?(5)4(2分)
4)abd(2分)?(5)4(2分)
本题解析:略
本题难度:一般