1、填空题 测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否不断溶解?________(填“能” 或“不能”),理由是____________________________________________________。
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果________(填“偏高”“偏低”或“无影响”)。原因是_________________________________________________
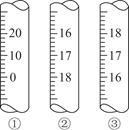
(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选________(填序号),在滴定接近终点时,应用蒸馏水润洗锥形瓶内壁,目的是________________________________________________________
参考答案:(1)不能 因为酚酞的变色范围为8~10,即pH范围呈碱性,而BaCO3需在酸性溶液中才会不断溶解
(2)偏高 因为甲基橙的变色范围的pH为3.1~4.4,当滴定到甲基橙由黄色变到橙色时,溶液的pH已经降到4.4以下,此时已有部分BaCO3与盐酸反应,故消耗的盐酸的量偏大
(3)② 使附着在锥形瓶壁上的未反应的溶液回到溶液中,减小滴定时的误差
本题解析:详见答案
本题难度:一般
2、选择题 25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L盐酸
B.0.01 mol/L Na2CO3溶液
C.pH =" 4" NaHSO3溶液
D.pH =11氨水
参考答案:A
本题解析:盐酸、NaHSO3溶液和氨水都抑制水电离,碳酸钠促进水电离,0.01mol/L盐酸中氢离子浓度是0.01mol/L,pH =" 4" NaHSO3溶液中氢离子浓度是0.0001mol/L,pH=11的氨水中氢氧根离子浓度是0.001mol/L,氢离子或氢氧根离子浓度越大,抑制水电离程度越大,所以水电离程度最小的是盐酸,选A。
本题难度:一般
3、填空题 (8分)为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16g该气体燃料,完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903KJ的热量。请写出:
CNG的化学式 ,其完全燃烧的热化学方程式 。
参考答案:CH4 CH4(g)+2O2 (g)=CO2(g)+2H2O(l) △H= -890.3kJ/mol
本题解析:考查热化学方程式的书写及反应热的有关计算等。
天然气的主要成分是甲 烷,化学式是CH4;0.16g该气体燃料,完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903KJ的热量,则16g即1mol甲烷完全燃烧放出的热量应该是8.903KJ×100=890.3kJ,所以该反应的热化学方程式是CH4(g)+2O2 (g)=CO2(g)+2H2O(l) △H= -890.3kJ/mol。
本题难度:一般
4、选择题 在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为
A.0.1 mol
B.0.15 mol
C.0.25 mol
D.0.35 mol
参考答案:D
本题解析:由于溶液是显电中性的,则有0.15mol+0.25mmol×3=0.2mol+2x,解得x=0.35mol,答案选D。
点评:该题是中等难度的试题,侧重对学生灵活运用基础知识解决实际问题的能力的培养。该题的关键是利用好电荷守恒定律,然后结合题意灵活运用即可。
本题难度:简单
5、实验题 用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)准确称取一定量的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯?(B)洁净纸片?(C)直接放在托盘上
(2)准确量取10.00ml待测液于锥形瓶中,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用?(填编号字母)作指示剂。 (A)甲基橙?(B)石蕊?(C)酚酞?
(3)若选用甲基橙作指示剂,滴定终点的判断依据是?
?此时溶液显?性。
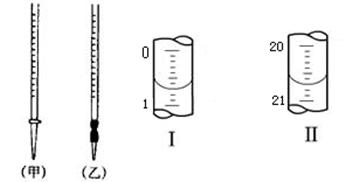
(4)0.2000mol·L-1的盐酸应装在下图所示的??(填甲、乙)中,图Ⅰ所示为滴定前液面,图Ⅱ所示为滴定结束时液面,根据图示计算被测烧碱溶液的物质的量浓度是?mol·L-1。
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果?。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果?。
参考答案:(1)(A)?(2)(B)
(3)当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化?酸
(4)甲?0.4000 ?(5)①偏高?②偏高
本题解析:(1)氢氧化钠是易潮解的物质,所以称量时必须要用烧杯或表面皿。
(2)石蕊的变色范围为5—8,变色范围较大,不适宜做指示剂。
(3)酸滴碱用甲基橙做指示剂,甲基橙的颜色由黄变为橙色,所以滴定终点的判断依据是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化,甲基橙的变色范围是3.1-4.4,此时溶液呈酸性。
(4)盐酸应该用酸式滴定管盛装,因此选择甲。如图可以看出所用酸的体积为20.00mL,根据c(H+)V(H+)= c(OH-)V(OH-),可以求出NaOH的浓度为0.4000。
(5)c(OH-)=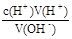 ,开始俯视,滴定终点平视,所用HCl的体积比正常值大,所以偏高。若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,所用HCl的体积比正常值大,所以偏高。
,开始俯视,滴定终点平视,所用HCl的体积比正常值大,所以偏高。若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,所用HCl的体积比正常值大,所以偏高。
点评:酸碱中和滴定是化学实验的基础题,其中要重视滴定终点的判断。
本题难度:一般