1、选择题 将1gH2和4gO2混合点燃,充分反应,放出71.45kJ热量,同样条件下1molH2在O2中完全燃烧放出的热量是
A.71.45kJ
B.142.9kJ
C.571.6kJ
D.285.8kJ
参考答案:D
本题解析:
正确答案:D
2H2+O2=2H2O,将1gH2和4gO2混合点燃,只反应0.5gH2, 1molH2在O2中完全燃烧放出的热量是71.45kJ×2g/0.5g=285.8kJ,D正确。
本题难度:简单
2、选择题 室温时,将xmLpH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
参考答案:D
本题解析:由题可知,n(NaOH)=x×10-3×10a-14mol,n(HCl)= y×10-3×10-bmol。
故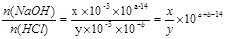 ,分步讨论:
,分步讨论:
(1)若x=y,,则n(NaOH)=n(HCl),二者恰好反应,pH=7
(2)若10x=y,且a+b=13,则n(HCl)=100n(NaOH),HCl过量,pH<7
(3)若ax=by,且a+b=13,则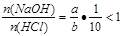 (因a>7,b<7),HCl过量,
(因a>7,b<7),HCl过量,
(4)若x=10y,且a+b=14,则 ,NaOH过量,pH>7
,NaOH过量,pH>7
所以答案选D。
点评:混合溶液pH的计算要注意过量问题。
本题难度:一般
3、选择题 下列热化学方程式中,能表示可燃物的燃烧热的是( )
A.C(s)+
O2(g)═CO(g)△H=-110.5J?mol-1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
C.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
D.CO(g)+O2(g)═CO2(g)△H=-283kJ?mol-1
参考答案:A.1molC不完全燃烧生成CO,不符合燃烧热的概念要求,不是燃烧热,故A错误;
B.生成物为稳定的氧化物,水应为液态,故B错误;
C.燃烧热是指1mol纯净物完全燃烧,方程式中为2mol,不是燃烧热,故C错误;
D.1molCO完全燃烧生成稳定的CO2,符合燃烧热的概念要求,放出的热量为燃烧热,故C正确;
故选D.
本题解析:
本题难度:简单
4、选择题 下列燃料中,不属于化石燃料的是
A.煤矿
B.石油
C.水煤气
D.天然气
参考答案:C
本题解析:化石燃料是补课再生的,常见化石燃料是煤、石油和天然气等。水煤气是可再生的,不是化石燃料,答案选C。
本题难度:简单
5、选择题 某温度下纯水的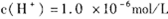 、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
A.11:1
B.9: 2
C.1:11
D.2:9
参考答案:D
本题解析: 说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,
说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,
酸碱混合后,pH=7,则溶液呈碱性,反应剩余 c(OH-)="0.1" mol/L,
则(10-6×x-10-5y)/( x+y) ="0.1" mol/L,
解得x:y=2:9,
故选D。
点评:本题考查酸碱混合的计算,明确混合后pH=10为碱过量是解答本题的关键,并注意pH与浓度的换算来解答,题目难度不大。
本题难度:一般