1、填空题 (10分)农村还有些家庭直接用河水或池塘水或井水龙头作为生活饮用水,一般是把水担回家倒入水缸,加明矾使水澄清,加漂白粉进行消毒,煮沸消除暂时硬度,明矾的化学式为?,写出它溶于水后生成胶体的离子方程式:?。漂白粉的成分是?,它在自然条件下能产生次氯酸,次氯酸的氧化性很强,能杀死病菌。写出漂白粉在空气中生成次氯酸的化学方程式:?。煮沸时形成水垢的成份是?(填化学式)
参考答案:KAl(SO4)2·12H2O? Al3++3H2O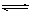 Al(OH)3(胶体)+3H+?
Al(OH)3(胶体)+3H+?
CaCl2、Ca(C1O)2? Ca(C1O)2+CO2+2H2O=CaCO3↓+2HClO
CaCO3、Mg(OH)2
本题解析:明矾的化学式为KAl(SO4)2·12H2O 。明矾溶于后,铝离子水解水生成氢氧化铝胶体,方程式为Al3++3H2O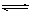 Al(OH)3(胶体)+3H+。漂白粉是混合物,含有CaCl2、Ca(C1O)2。次氯酸钙能吸收空气中的水和CO2,生成次氯酸,方程式为Ca(C1O)2+CO2+2H2O=CaCO3↓+2HClO。水垢的成份是碳酸钙和氢氧化镁。
Al(OH)3(胶体)+3H+。漂白粉是混合物,含有CaCl2、Ca(C1O)2。次氯酸钙能吸收空气中的水和CO2,生成次氯酸,方程式为Ca(C1O)2+CO2+2H2O=CaCO3↓+2HClO。水垢的成份是碳酸钙和氢氧化镁。
本题难度:一般
2、填空题 (9分)实验室要配制100mL? 0.5mol·L-1的NaCl溶液,试回答下列各题。
(1)经计算,应该用托盘天平称取NaCl固体_________g。
(2)若用NaCl固体配制溶液,需使用的玻璃仪器有_________________?______________
(3)配制过程有以下操作:A.移液,B.称量,C.洗涤,D.定容,E.溶解,F.摇匀。其正确的操作顺序应是_____________________________ (填序号)。
(4)下列操作会导致所得溶液浓度偏低的是______________________________(填序号)。
A.定容时仰视容量瓶刻度线? B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
参考答案:(1)___2.9__(2’)?(2)____烧杯、玻璃棒、100m L容量瓶、胶头滴管____(3’,缺一个扣1分,缺两个扣两分,只写一个全扣)
(3)____BEACADF___(2’)?(4)___ACD__(2’,缺一个扣1分,缺两个全扣)
本题解析:略
本题难度:简单
3、实验题 实验室以空气(O2体积分数20%)为原料,在无碳、无水的环境下,用下图A装置制备臭氧(3O2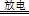 2O3)。
2O3)。
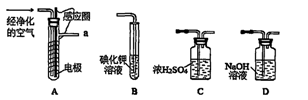
(1)空气通入A装置之前,应先后通过上述装置中的?、?(填装置序号)。
(2)臭氧与碘化钾溶液反应为:2KI+O3+H2O=2KOH+I2+O2。将a处气体通入装置B,溶液中的现象为?。
(3)为测定O2转化为O3的转化率,将装置B中的溶液全部转入另一容器中,加入CC14,经萃取、分液、蒸馏、冷却、称重,得I2固体0.254g。
①萃取操作所用玻璃仪器的名称?。
②若实验时通入空气1.12L(标准状况),O2的转化率为?。
③测定时需在A、B装置间连接装置D,原因是?。
(4)工业上分离O3和O2,可将混合气体液化后再分离,下列分离方法合理的是?(填序号)。
A.过滤 B.分馏 C.分液 D.萃取
(5)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步:OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为?。
参考答案:(15分)(1)D、C(各1分,2分)?
(2)溶液变黄色(其他合理答案给分,2分)?
(3)①分液漏斗(1分)?
②15%(3分)
③除去混合气体中的氮氧化物(其他合理答案给分,2分)?
(4)B(2分)?
(5)2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O(3分)
本题解析:(1)根据无碳无水环境条件,则空气通入A装置前应先后通过NaOH溶液、浓H2SO4的洗气瓶;(2)a处气体通入B,臭氧能氧化KI,溶液中因生成的I2变黄;(3)①萃取使用分液漏斗、烧杯;②由m/M可知n(I2)=0.254g÷254g/mol=0.001mol,由2KI+O3+H2O=2KOH+I2+O2可知,n(O3)=0.001mol,由3O2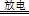 2O3可知,n(O2)=0.0015mol,由V/Vm可知n(空气)=0.05mol,由空气的组成可知,n(O2)=0.01mol,因此O2得转化率为0.0015÷0.01×100%=15%;③NaOH溶液能除去空气中氮气和氧气在放电时产生的氮氧化物,防止NO2与KI溶液反应;(4)臭氧和氧气先液化,二者沸点不同,可用分馏的方法分离,故B正确;(5)第一步反应中碳元素由+2价升为+4价,第二步反应中氮元素由—3价升为0价,部分氧元素由0价将为—2价,则两步反应分别为O3+CN—=OCN—+O2、2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O。
2O3可知,n(O2)=0.0015mol,由V/Vm可知n(空气)=0.05mol,由空气的组成可知,n(O2)=0.01mol,因此O2得转化率为0.0015÷0.01×100%=15%;③NaOH溶液能除去空气中氮气和氧气在放电时产生的氮氧化物,防止NO2与KI溶液反应;(4)臭氧和氧气先液化,二者沸点不同,可用分馏的方法分离,故B正确;(5)第一步反应中碳元素由+2价升为+4价,第二步反应中氮元素由—3价升为0价,部分氧元素由0价将为—2价,则两步反应分别为O3+CN—=OCN—+O2、2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O。
本题难度:一般
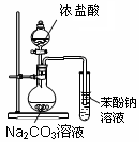
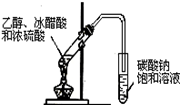
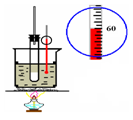
4、选择题 下列实验装置图(有些图中部分夹持仪器未画出)不能达到其实验目的的是?
| 
|
A.证明酸性:盐酸>碳酸>苯酚
| B.实验室制取乙酸乙酯
|

| 
|
C.石油分馏
| D.实验室制取硝基苯
参考答案:A
本题解析:A中碳酸钠与浓盐酸反应产生的CO2中混合着大量的HCl气体,苯酚钠溶液出现浑浊不能判断为是CO2生成碳酸与苯酚钠反应的结果。。
本题难度:一般
5、选择题 实验室中制取的下列气体中,不能用排空气法收集的是?(?)
A.NO2
B.NH3
C.HCl
D.NO
参考答案:D
本题解析:NO具有被氧气氧化生成NO2,所以NO不能用排空气法收集,其余都是可以的,答案选D。
本题难度:一般
|