1、选择题 若某反应的方程式为:A+酸===盐+水,则A不可能属于( )
A.氧化物
B.碱
C.单质
D.电解质
参考答案:C
本题解析:单质和酸反应不可能是盐和水,其余都是可能的,答案选C。
本题难度:一般
2、选择题 下列氧化还原反应中,水作为氧化剂的是(?)?
A.CO+H2O(g)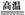 CO2+H2?
CO2+H2?
B.3NO2+H2O 2HNO3+NO?
2HNO3+NO?
C.2Na2O2+2H2O 4NaOH+O2↑
4NaOH+O2↑
D.2F2+2H2O 4HF+O2?
4HF+O2?
参考答案:A
本题解析:氧化剂得到电子,化合价应该降低,所以选项A正确。B、C中水既不是氧化剂,也不是还原剂。D中水是还原剂,答案选A。
本题难度:简单
3、选择题 在以下4个反应中,铁元素的化合价变化与另外3个反应不同的是
A.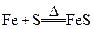
B.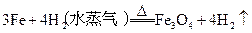
C.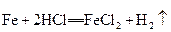
D.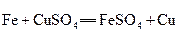
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (7分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)写出一个包含上述七种物质的氧化还原反应方程式:
________________________________________________________________________。
(2)上述反应中,氧化剂是?,2 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(3)如果在上述反应后的溶液中加入NaBiO3,溶液又变紫红色。根据上述实验现象,判断KMnO4、Cl2、NaBiO3三种物质的氧化性由强到弱的排列顺序是:___________________。
参考答案:
(1)2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O(2分)(未配平扣1分)
(2)KMnO4 ?得到 ? 10?(各1分)
(3)NaBiO3>KMnO4>Cl2?(2分)
本题解析:盐酸滴入高锰酸钾溶液中,产生黄绿色气体,黄绿色气体是氯气,这说明高锰酸钾的氧化性强于氯气的。即酸性高锰酸钾溶液能氧化氯离子生成氯气,因此反应的方程式为2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O。其中高锰酸钾是氧化剂,转移的电子是10,所以2 mol氧化剂在反应中得到10mol电子。溶液又变紫红色,说明硫酸锰又被氧化生成了高锰酸钾,这说明NaBiO3的氧化性强于高锰酸钾的。
本题难度:一般
5、选择题 FeS与足量的稀硝酸反应,生成Fe(NO3)3、S、NO和H2O。若反应中有0.3 mol的电子转移,则参加反应的硝酸中未被还原的硝酸的物质的量为(?)
A.0.9 mol
B.0.45 mol
C.0.3 mol
D.0.1 mol
参考答案:C
本题解析:根据反应前后的化合价的变化可知,FeS是还原剂,每消耗1molFeS反应中就转移3mol电子。所以消耗FeS是0.1mol,则必然生成0.1mol硝酸铁,即未被还原的硝酸是0.3mol,所以答案选C。
本题难度:简单