1、选择题 某氮的氧化物和CO在催化剂的作用下充分反应,生成氮气和CO2 ,若测得氮气和CO2的物质的量之比为1:2,则该氮的氧化物是
A.N2O
B.N2O5
C.NO2
D.NO
参考答案:D
本题解析:根据氧化还原反应中得失电子守恒规律,CO中C元素升高2价,失去电子数为2×2,设氮的氧化物中氮元素的化合价为+x,氮的氧化物中氮元素降低到0价,则生成氮气得到电子数为2×x,所以2×2=2×x,则x=2,所以氮的氧化物中氮元素的化合价为+2,答案选D。
本题难度:一般
2、选择题 某炼金厂的废水因连降暴雨而溢出,导致河水严重污染,炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是 ( ?)
A.CN-可以和稀硫酸反应生成HCN
B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2不能将F-氧化
D.HCN的电子式为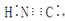
参考答案:D
本题解析:HCN为弱酸,则根据较强酸制备较弱酸的原理可知,选项A正确;CN-还原性介于I-与Br-之间,所以能被氯气氧化,B正确;(CN)2的氧化性弱于单质氟的,因此在水溶液中(CN)2不能将F-氧化,C正确;D不正确,电子式应该是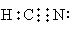 ,答案选D。
,答案选D。
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
3、选择题 Cu和稀HNO3反应时,Cu被HNO3氧化成Cu(NO3)2,又知该反应中氧化剂和还原剂个数之比是2∶3。该反应中HNO3的还原产物是(? )
A.NO2
B.NO
C.N2
D.NH4NO3
参考答案:B
本题解析:依据化合价升降总数相等,还原剂是Cu,氧化产物是Cu(NO3)2,假设还原剂个数为3个,共升高3×2=6价。那么氧化剂为2个,降价总数也为6价,HNO3为氧化剂,从+5价降低到+2价,还原产物中N元素化合价为+2。
本题难度:简单
4、填空题 以下是依据一定的分类标准,对某些物质与水反应的情况进行分类的分类图。请根据你所学的知识,按要求填空:
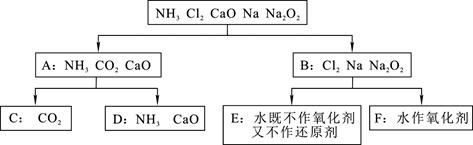
(1)上述物质的分类方法是?;
(2)根据物质与水反应的情况,分成A、B组的分类依据是?(选择字母填空,下同),由A组分成C、D组的依据是?(填字母)。
a.与水反应后溶液的酸碱性? b.与水反应的剧烈程度? c.是否发生氧化还原反应
(3)F组的物质是?(填化学式)。
(4)A组中的酸性氧化物与B组中的某物质反应可用作呼吸面具或潜水艇中氧气的来源,其反应方程式为?。
参考答案:(6分)(1)树状分类法(1分);?(2)c(1分);a(1分);?(3)Na(1分);
(4)2Na2O2 + 2CO2=2Na2CO3 + O2(2分);
本题解析:(1)根据示意图的结构特点可知,上述物质的分类方法是树状分类法。
(2)由于氨气、CO2和氧化钙在和水的反应都不是氧化还原反应,而氯气、钠和过氧化钠与水的反应是氧化还原反应,据此标准可以分类,答案选c。氨气和氧化钙溶于水,溶液显碱性,CO2溶于水显酸性,答案选a。
(3)钠和反应中,钠是还原剂,水是氧化剂,即F是钠。氯气、过氧化钠和水的反应中,水既不是氧化剂,也不是还原剂。
(4)过氧化钠和CO2反应生成氧气和过氧化钠,反应的化学方程式是2Na2O2 + 2CO2=2Na2CO3 + O2。
点评:该题是中等难度的试题,试题设计新颖,基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是分类标准的确定。
本题难度:一般
5、实验题 某校研究小组为探究KI溶液的pH与其在空气之中氧化变质的关系,进行了相应的实验探究。
【提出假设】
假设1:只有碱性环境下能被氧化
假设2:只有酸性环境下能被氧化
假设3:只有中性环境下能被氧化
假设4: ?能被氧化
【实验探究】
(1)有人认为由于I2会和KOH反应,因此否定假设1。小组同学认为,若溶液的碱性较弱时,I2不会反应。为了验证滚点,小组同学进行了下述实验:
在编号为①②③的试管中加入相同量的碘的淀粉溶液中,然后分别加入pH为9、10、11的KOH溶液,发现试管①中蓝色不消失,试管②③中蓝色消失。
由此可以得出结论:?。
(2)为探究KI溶液在不同碱性条件下能否被氧气氧化,小组同学设计了以下实验:将下表中的药品分别加入到试管中,然后放置于收集有氧气的储气瓶中,塞上塞子,观察现象。完成以下实验设计表(表中不要留空格)。
实验编号
| 蒸馏水
| 淀粉溶液
| KI固体
| 稀KOH溶液
| 一段时间后观察实验现象
|
1
| 30mL
| 2 mL
| 5g
| 0滴
| 试管中出现了蓝色
|
2
| 29.5 mL
| ?
| 5g
| 10滴
| 试管中出现了很浅的淡蓝色
|
3
| 29 mL
| 2 mL
| ?
| 20滴
| 试管中无明显变化
|
4
| ?
| 2 mL
| 5g
| 30滴
| ?
|
?
注:1滴溶液体积为0.05mL。
(3)小组同学通过实验证实了在酸性条件下KI都能被氧气氧化,现继续探究酸性强弱与氧化难易的关系。有同学提出假设,认为酸性越强越容易被氧化。请设计实验验证假设,完成下表中内容。
可供选择的药品有:KI固体、淀粉溶液、0.005mol/L H2SO4、0.5mol/L H2SO4。
实验方案(不要求写具体过程)
| 预期实验结果和结论
|
?
| ?
|
?
参考答案:
假设4:在一定pH范围内(1分,合理表述均给分)
(1)碘单质只有在pH大于一定值时才能和碱性溶液反应(1分,合理表述均给分)
(2)
实验编号
蒸馏水
淀粉溶液
KI固体
稀KOH溶液
一段时间后观察实验现象
1
?
?
?
?
?
2
?
2mL
?
?
?
3
?
?
5g
?
[]
4
28.5 mL
?
?
?
试管中无明显变化
?
(3)
实验方案(不要求写具体操作过程)
预期实验结果和结论
在编号为①②③的试管中分别加入0.005mol/L H2SO4、0.05mol/L H2SO4、0.5mol/L H2SO4各30mL,然后再向三只试管中分别加入2mL淀粉溶液、5g KI固体(2分)
若都出现蓝色,且①②③试管中颜色依次加深,则酸性越强越容易被氧化,假设正确。否则,假设错误。
(1分)
本题解析:结合题目前后的实验探究过程,可得出假设4为在一定pH范围内能被氧化。
(1)实验现象说明碱性较弱时,碘单质不会和碱发生反应
(2)根据变量控制的思想,不难填充表格中的数据,第4组中KOH滴加得最多,碱性最强,可推知试管中也无明显变化。
本题难度:一般