1、简答题 A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子,其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性.请回答:
(1)用化学符号表示上述5种微粒:
A______,B______,C______,D______,E______.
(2)在水溶液中A跟B反应的离子方程式是:______.
2、判断题 (15分)有X、Y、Z、W四种短周期元素原子序数依次增大,它们之间可以同时相互形成A2B2型、AB型、A2型、A22—型等具有相同电子数的微粒。
(1)当A2型微粒为空气的主要成分时:
①写出上述A22—型微粒电子式 _______________。
②写出四种元素原子按5:1:1:3形成的离子化合物与足量NaOH反应的离子方程式_______________。
(2)当A2型微粒为最活泼的单质时:
①1mol A2B2型化合物分解转移电子的物质的量为_______。
②任写出一种具有相同电子的其他非极性分子的有机物化学式__________
③比较Z与W两种元素的氢化物的沸点与水溶液的酸性。沸点________________酸性______________。
3、选择题 X盐和Y酸反应,可放出有气味的气体Z;Z跟NaOH溶液反应又得到X;Z氧化的最终产物为W ,W溶于水又得到Y,则X和Y是
A.Na2S和H2SO4
B.Na2SO3和盐酸
C.Na2S和盐酸
D.Na2CO3和H2SO4
4、填空题 (10分)已知常见金属单质A有以下物质相互转化
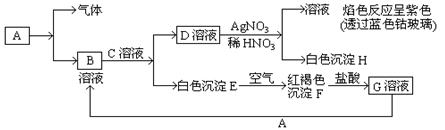
试回答:
(1)写出B的化学式?,D的化学式?。
(2)写出由E转变成F的化学方程式?。
(3)写出检验G溶液中的金属阳离子的试剂是(写化学式)?;向G溶液加入A的有关离子反应方程式?。
5、推断题 已知A是短周期非金属元素形成的单质,B是某纯净物或其溶液,二者之间的反应可表示为:A+B→C +D(若生成物有三种且有水时,水被略去)。
(1)若该反应在常温下能剧烈发生,C、D中有一种物质的溶液能腐蚀玻璃,则反应的化学方程式可表示为________________
(2)若A、C、D均含有氧元素,且这三种物质混合后能形成一种新物质E,B与E能发生化合反应生成盐F,则F中含有的化学键类型有____________,F中阴、阳离子的电子数之比为________________。
(3)若A为固体,B为碱溶液,C与D在酸性条件下又能转化为A,则A与B反应的离子方程式为________________________。
(4)若A、B、C均为固体,D为气体。写出两个满足此条件的化学方程式:____________、 ____________