1、选择题 在一个绝热的固定容积的密闭容器中发生可逆反应:(g) + 3(g)  2(g);
2(g);
△H<0,下列各项中不能说明该反应已经达到平衡状态的是
A.体系的压强不再改变
B.体系的温度不再改变
C.消耗1mol的同时,新生成3mol
D.反应消耗的、与产生的的速率υ():υ():υ() ==1: 3 : 2
2、填空题 (7分)在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2?2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白。
已知编号
| 始态的物质的量(mol)
| 平衡时NH3的
物质的量(mol)
|
N2
| H2
| NH3
|
已知
| 1
| 4
| 0
| a
|
①
| ?
| ?
| 1
| 0.5a
|
②
| 1.5
| 6
| 0
| ?
|
③
| m
| n( n≥4m)
| ?
| ?
3、计算题 (3分)把 3mol A 和 2.5mol B 混合于 2L 的密闭容器中,使它们发生反应:
3A(气) + B(气) 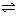 xC(气) + 2D(气) xC(气) + 2D(气)
经5min后达到平衡生成1mol D,并测定C的平均速率为0.1 mol/L·min,则此反应中的B的转化率为________,C的系数为_______________,A的平衡浓度为_____________。
20%,2,? 0.75 mol /L
4、简答题 SO2常用于制硫酸,其中一步重要的反应为2SO2(g)+O2(g)?2SO3(g)△H<0.若向一个2L的密闭容器中充入0.4mol?SO2、0.2mol?O2和0.4mol?SO3发生上述反应.
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为______.
(3)某温度时,将4mol?SO2和2mol?O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=______,该温度下反应2SO2(g)+O2(g)?2S03(g)的平衡常数K=______.
5、填空题 (7分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为VL。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g) 2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V?L。请回答: 2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V?L。请回答:

(1)乙中B的转化率为 ?。
(2)甲中D和乙中C的物质的量比较:?(填“相等”、“前者大”、“后者大”)。
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为?(用含V的代数式表示,连通管中气体体积忽略不计)。
|