?
参考答案:① n (N2)="0" (1分)? n (H2)="0.5" (1分)? ② n(NH3)="1.5a" (1分)
③始态NH3为:2(n-4m)? (2分)?平衡时NH3为(n-3m)a? (2分)
本题解析:(1)在保持恒压时要使平衡等效,则最初的投料的比值是相同的,根据题意可知最初的氮气和氢气的体积之比是1︰4的,所以通过方程式换算后的氮气和氢气的体积之比必须满足1︰4。在实验③中设氨气的物质的量是x,则xmol氨气可以生成0.5xmol氮气和1.5xmol氢气,则一定有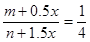 ,解得x=2(n-4m)mol。平衡是等效的,所以各种物质的含量分别是相同的,所以平衡时氨气的物质的量是不同的。氨气的物质的量和起始时氮气的物质的量成正比。 ,解得x=2(n-4m)mol。平衡是等效的,所以各种物质的含量分别是相同的,所以平衡时氨气的物质的量是不同的。氨气的物质的量和起始时氮气的物质的量成正比。
本题难度:一般
3、计算题 (3分)把 3mol A 和 2.5mol B 混合于 2L 的密闭容器中,使它们发生反应:
3A(气) + B(气) 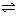 xC(气) + 2D(气) xC(气) + 2D(气)
经5min后达到平衡生成1mol D,并测定C的平均速率为0.1 mol/L·min,则此反应中的B的转化率为________,C的系数为_______________,A的平衡浓度为_____________。
20%,2,? 0.75 mol /L
参考答案:
本题解析:3A?+ ?B ? xC? + ?2D ? xC? + ?2D
始n:? 3mol ?2.5mol ?0? 0
△n:?1.5mol?0.5mol?1mol? 1mol
平n:1.5mol?2mol?0.1×2×5?1mol
本题难度:一般
4、简答题 SO2常用于制硫酸,其中一步重要的反应为2SO2(g)+O2(g)?2SO3(g)△H<0.若向一个2L的密闭容器中充入0.4mol?SO2、0.2mol?O2和0.4mol?SO3发生上述反应.
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为______.
(3)某温度时,将4mol?SO2和2mol?O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=______,该温度下反应2SO2(g)+O2(g)?2S03(g)的平衡常数K=______.
参考答案:(1)SO2、O2、SO3起始浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,
A、SO2和O2的浓度增大,SO2、O2的浓度增大分别为0.1mol/L、0.05mol/L,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,实际变化应小于该值,且为2:1,故A可能;
B.SO3的浓度增大,浓度增大为0.2mol/L,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故B不可能;
C.SO2、O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,实际变化应小于该值,故C不可能;
D.SO3的浓度增大,浓度增大为0.1mol/L,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故D可能;
故答案为:AD;
(2)选则A计算平衡常数,SO2、O2的浓度增大分别为0.1mol/L、0.05mol/L,则SO3的浓度减少量为0.1ml/L,故平衡时SO3的浓度为0.2mol/L-0.1ml/L=0.1mol/L,故平衡常数k=0.120.32×0.15=0.74;
故答案为:0.74;
(3)SO2的转化率为80%,则参加反应的SO2为4mol×80%=3.2mol,故参加反应的O2为3.2mol×12=1.6mol,故v(O2)=1.6mol2L10min=0.08mol/(L?min);
计算SO2、O2的起始浓度分别为2mol/L、1mol/L,SO2的浓度变化量为3.2mol2L=1.6mol/L,则:
? 2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):2? 1? 0
变化(mol/L):1.6? 0.8? 1.6
平衡(mol/L):0.4? 0.2? 1.6
故该温度下平衡常数k=1.620.42×0.2=80,
故答案为:0.08mol/(L?min);80.
本题解析:
本题难度:一般
5、填空题 (7分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为VL。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g) 2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V?L。请回答: 2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V?L。请回答:

(1)乙中B的转化率为 ?。
(2)甲中D和乙中C的物质的量比较:?(填“相等”、“前者大”、“后者大”)。
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为?(用含V的代数式表示,连通管中气体体积忽略不计)。
参考答案:
(1)60℅(2分)
(2)前者大(2分)?
(3)0.815V(3分)
本题解析:
(1)利用方程式进行计算:
3A(g)+2B(g) 2C(g)+4D(g) 2C(g)+4D(g)
n(初) 3mol? 7mol
Δn? 9a mol? 6a mol?6a mol? 12a mol
n(末)(3-9a) mol (7-6a)mol ?6a mol? 12a mol
所以:(3-9a+7-6a+6a+12a)/10=12.1,a="0.7" ,则B的转化率为 6a/7=60%
(2)转根据等效平衡的原则,乙中反应物的量为甲中的两倍,但是乙的平衡状态中各物质的量小于甲的两倍,并且乙中加压使平衡逆移动,所以乙中C的物质的量比甲中D的物质的量小。
(3)甲乙混合后,与乙的平衡状态Ⅰ为等效平衡。以60%的转化率来计算甲剩余的气体体积。则乙的体积为0.815V。
点评:本题以常见的活塞做模型,配以简单的化学计算,最后一空需对等效平衡进行理解。。
本题难度:一般
|