1、填空题 483g Na2SO4·10H2O中所含的Na+的物质的量是? 和SO42-的物质的量是? ,所含H2O分子的数目是? 个。
参考答案:3mol;1.5mol;15NA
本题解析:
本题难度:简单
2、填空题 A、B两种金属元素的相对原子质量之比为8∶9,将A、B两种金属单质按物质的量之比为3∶2组成1.26 g混合物。将此混合物与足量稀硫酸溶液反应,放出1.344 L(标准状况)氢气。若这两种金属单质在反应中生成氢气的体积相等,则A的摩尔质量是? ?,B的摩尔质量是? ?。
参考答案:24 g·mol-1 27 g·mol-1?
本题解析:两金属共生成H2的物质的量=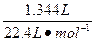 ="0.06" mol;两金属生成H2的物质的量相等,各为0.03 mol;A、B物质的量比为3∶2,可推出A为+2价,B为+3价;A为0.03 mol,B为0.02 mol。设相对原子质量的公比为a,则8a×0.03+9a×0.02="1.26" g
="0.06" mol;两金属生成H2的物质的量相等,各为0.03 mol;A、B物质的量比为3∶2,可推出A为+2价,B为+3价;A为0.03 mol,B为0.02 mol。设相对原子质量的公比为a,则8a×0.03+9a×0.02="1.26" g
解得a=3,m(A)="24" g·mol-1,m(B)="27" g·mol-1。
本题难度:简单
3、填空题 某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
参考答案:(1)否 (1分)CaHCl (2分)
(2)2CaHCl + 2H2O = CaCl2 + Ca(OH)2 + 2H2↑(2分)
取样,加稀HNO3溶解后分成二等份,其中一份加入Na2CO3溶液,得到CaCO3沉淀,称重后求得n(Ca2+);另一份加入AgNO3溶液,得到AgCl沉淀,称重后求得n(Cl-), 用下式即可求得x值: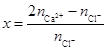 (3分,其它合理答案也给分)
(3分,其它合理答案也给分)
(3)2Cl- + MnO2 + 4H+= Mn2+ + Cl2↑+ 2H2O (2分)
保持FeCl2溶液呈酸性,并加入铁粉防止氧化 (2分)
(4)Ca + CaCl2 = 2CaCl
本题解析:(1)化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%,加起来比100%小,表明该物质中还含有氢元素,其质量分数为:100%-52.36%-46.33%=1.31%。因此,可以来确定甲这种物质的化学式:
N(Ca)
本题难度:一般
4、选择题 标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是( )
A.体积大小:④>③>②>①
B.密度大小:④>②>③>①
C.原子数目:③>①>④>②
D.质量大小:④>③>②>①