1、选择题 五种短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。W的质子数是Y的2倍,下列说法正确的是
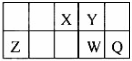
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z 3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
参考答案:A
本题解析:根据W的质子数是Y的2倍,即2Y=W=8+Y,Y是O;W是S;周期表的结构可推出其它元素分别为:X:N;Z:Al;Q :Cl,A中元素最高正化合价一般等于其主族数。B中同周期原子半径从左到右依次减小,同主族从上到下依次增大。C中离子Y2-和Z 3+都为10微粒,核外电子数和电子层数都相同。D中元素最高价氧化物对应的水化物的酸性是与非金属性一致的,因此酸性Q的强。
本题难度:一般
2、选择题 几种短周期元素的原子半径及主要化合价如下表:

下列叙述正确的是 (?)
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于氨水
D.Z的气态氢化物与其最高价氧化物对应的水化物可以反应
参考答案:D
本题解析:A.原子半径越小,原子失去电子就越难,元素的金属性就越弱。所以X、Y元素的金属性? X>Y 。错误。B.由于Z的最高化合价为+5,所以该元素是第ⅤA的元素N,W为第ⅥA的元素O。因为在任何化合物中正负化合价的代数和为0。所以在一定条件下,Z单质与W的常见单质直接生成NO。错误。C.Y是Al,其最高价氧化物对应的水化物Al(OH)3是两性氢氧化物。能跟强酸或强碱发生反应而溶解。但是由于一水合氨是弱碱,所以Al(OH)3不能溶于氨水。错误。D.N的气态氢化物NH3与其最高价氧化物对应的水化物HNO3可以反应生成NH4NO3。正确。
本题难度:一般
3、选择题 短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是( )
A.最外层电子数:甲>乙>丙>丁>戊
B.简单离子的离子半径:戊>丁>丙
C.含有丁元素的酸有多种
D.乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
参考答案:C
本题解析:戊是同周期中原子半径最小的元素,则戊是Cl,所以丁是S,丙是N,乙是C,甲是B。同周期自左向右最外层电子数逐渐最多,A不正确。核外电子排布相同的微粒,其微粒半径 随原子序数的增大而减小,因此B中应该是丁>戊>丙,B不正确。C正确,例如硫酸、亚硫酸、氢硫酸等。N的氢化物不止一种,例如氨气、N2H4等,D不正确,答案选C。
本题难度:简单
4、选择题 下列关于卤族元素的说法中,不正确的是
A.卤素单质随着核电荷数的增加,熔沸点逐渐升高
B.酸性HF>HCl>HBr>HI
C.沸点HF<HCl<HBr<HI
D.将Cl2通入KBr溶液中,滴入四氯化碳,如果下层溶液呈橙色,说明氯的非金属性比溴强
参考答案:BC
本题解析:酸性应该是HI>HBr>HCl>HF,B不正确;HF分子间存在氢键,沸点最高,C不正确,沸点应该是HCl<HBr<HI<HF,AD正确,答案选BC。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,侧重对学生灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的学习效率和应试能力。
本题难度:简单
5、选择题
A.与C60中普通碳原子的化学性质不同
B.与12C所含的中子数相同
C.是C60的同素异形体
D.与12C互称同位素
参考答案:D
本题解析:本题考查同位素、同素异形体概念。同位素原子的质子数相同,中子数不同;由于同位素原子的电子排布相同,所以其化学性质相同。
本题难度:一般