1、填空题 (4分)A、B、C、D四种短周期元素,原子序数依次增大,A元素原子最外层电子数是次外层的2倍,0.05 mol B元素的离子得到的6.02×1022个电子后被还原为中性原子;0.4g B的氧化物恰好与100mL 0 .2mol/L的盐酸完全反应;B元素原子核内质子数与中子数相等。C离子核外电子层数比A元素的离子核外电子层数多1,且形成离子化合物BC,D与A可形成化合物。请填空:
.2mol/L的盐酸完全反应;B元素原子核内质子数与中子数相等。C离子核外电子层数比A元素的离子核外电子层数多1,且形成离子化合物BC,D与A可形成化合物。请填空:
(1)A、B 两种元素的元素符号:B___________ 、C__________。
(2)D与A形成化合物分子式是________,分子空间构型是________。
参考答案:(1)Mg (2分);S (1分,写元素名称不得分)
(2)CCl4(1分)正四面体(1分)
本题解析:略
本题难度:简单
2、填空题 某同学在画某种元素的一种单核微粒的原子结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示作出自己的判断。
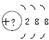
(1)该微粒是中性微粒,这种微粒的符号是__________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是__________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是__________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是__________。
参考答案:(1)Ar? (2)S2-? (3)K+? (4)Cl-
本题解析:题设中“微粒”的核外电子排布为2、8、8,是一种稳定结构,该微粒可以是原子,也可以是阴、阳离子。如果是中性微粒即原子,核内的质子数应该等于核外的电子数,即2+8+8=18个,质子数为18的元素是Ar;在溶液中能使溴水褪色并出现浑浊的物质应该是硫化物,该微粒应该是S2-;微粒得到1个电子后变为原子,则其原子的电子数应该为18+1=19个,质子数应该是19个,即钾原子,则这种微粒是K+,K+的氧化性很弱而钾的还原性很强,符合题目要求;微粒失去1个电子后变为原子,则其原子的电子数应该为18-1=17个,质子数应该是17个,即氯原子,则这种微粒是Cl-,Cl-的还原性很弱而氯原子的氧化性很强,符合题目要求。
本题难度:简单
3、选择题 下列分子中所有原子未全部满足最外层为8个电子结构的是
A.CCl4
B.CO2
C.BF3
D.PCl3
参考答案:C
本题解析:化合物中元素原子的化合价绝对值与该元素最外层电子数之和满足8,则可以说明原子满足最外层为8个电子结构,据此可知选项ABD都是正确的,C中B元素不能满足,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的创新思维能力,提高学生的应试能力。
本题难度:简单
4、填空题 (6分)A、B、C、D、E、F、G均为短周期元素,它们在周期表中的位置如图所示。
请按要求回答下列问题。
(1)A单质的收集方法为?。
(2)上述元素形成的单质中,还原性最强的是?(填写元素符号)。
(3)E元素是非金属性最强的元素,其阴离子的结构示意图是?。
(4)F、G元素的最高价氧化物对应水化物的酸性强弱顺序是?(填化学式)。
(5)B元素的最高价氧化物对应水化物与C元素的最高价氧化物对应水化物相互间反应的化学方程式是?。
参考答案:(6分)(1)排水集气法(或向下排气法)。(1分)?(2)Na?(1分)
(3) (1分)?(4)HClO4>H2SO4。(1分)
(1分)?(4)HClO4>H2SO4。(1分)
(5) NaOH +Al(OH)3 ===NaAlO2 + 2H2O?(2分)
本题解析:(1)A是氢气,密度比空气轻,排水集气法(或向下排气法)。
(2)形成的单质中,还原性最强的是Na,因为钠的半径最大,失电子能力最强
(3)E元素是氟,阴离子的结构示意图是

(4)F、G元素的最高价氧化物对应水化物分别是H2SO4、HClO4,酸性强弱顺序是HClO4>H2SO4
(5)相互间反应的化学方程式:NaOH +Al(OH)3 =NaAlO2 + 2H2O
本题难度:一般
5、选择题 发现原子中存在电子的科学家是
A.英国科学家道尔顿
B.英国科学家汤姆生
C.英国科学家卢瑟福
D.丹麦物理学家玻尔
参考答案:B
本题解析:略
本题难度:简单