1、填空题 (6分)36 g的H2O 和 60 g 的D2O 中, 它们所含有的原子总数之比为?,分子内的中子总数之比为?,若它们分别与足量的金属钠反应, 产生的气体的质量之比为?。
参考答案:2:3、? 8:15;? 1:3。(每空2分共6分)
本题解析:略
本题难度:简单
2、填空题 (10分)下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
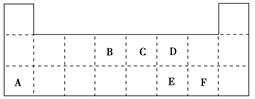
(1)1 mol A与足量D的氢化物完全反应产生的气体在标准状况下的体积为________L。
(2)写出B的最高价氧化物的电子式________。
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化:
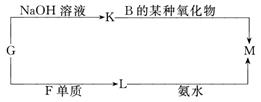
其中化合物M是一种白色胶状沉淀,则M为(填化学式)________________;
K的溶液与B的某种氧化物反应的化学方程式为____________________________;
一种新型无机非金属材料由G元素和C元素组成,其化学式为____________。
参考答案:(10分)(1)? 11.2 L(2分) ? (2) 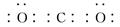 (2分)
(2分)
(3)Al(OH)3(2分) ? NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3(2分)
(或2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3) ? AlN(2分)
本题解析:依次可知为钠、碳、氮、氧、硫、氯
2Na+2H2O=2NaOH+H2↑ 氧化物为CO2,G为铝,2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3
本题难度:一般
3、选择题 根据理论研究,元素周期表可容纳164种元素。理论上164号、114号、14号元素位于同一主族。根据你所学知识,下列有关预测肯定不正确的是
A.164号元素是金属元素
B.164号元素位于ⅣA族
C.164号元素对应的最高价氧化物的水化物其碱性比114号的强
D.164号元素存在稳定的气态氢化物,且还原性比SiH4弱
参考答案:D
本题解析:硅是14号元素,位于第ⅣA族,所以B正确;同主族自上而下金属性逐渐增强,最高价氧化物的水化合物的碱性逐渐增强,AC正确,D不正确,答案选D。
本题难度:一般
4、选择题 下列递变规律正确的是
A.热稳定性:HCl>HF>H2O
B.元素的最高正化合价:F>S>C>K
C.碱性:NaOH>Mg(OH)2>Ca(OH)2
D.沸点:金刚石>硫>水>氮气
参考答案:D
本题解析:非金属性越强,相应氢化物的稳定性就越强,非金属性是F>O>Cl,A不正确。氟是最强的非金属,没有正价,B不正确。金属性越强,最高价氧化物的水化物的解析就越强,金属性是Ca>Na>Mg,C不正确。金刚石是原子晶体,所以沸点最高,因此选项D正确,答案选D。
本题难度:一般
5、选择题 天然存在的金属钫(Fr)极微量。它的21种已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是(? )?
A.在空气中燃烧时生成氧化物Fr2O
B.在已知元素中具有最大的原子半径
C.氧化物对应的水化物碱性极强
D.其单质的熔点比金属钠的熔点低
参考答案:A
本题解析:A.碱金属在空气中燃烧时生成氧化物Fr2O2、Fr O2等,错误;B.由于同一周期的元素,原子序数越大,原子半径越小,同一主族的元素,原子核外电子层数越多,原子半径就越大,所以在已知元素中具有最大的原子半径是元素周期表的左下角的元素Fr,正确;C.元素的金属性越强,其最高价氧化物对应的水化物碱性就越强,Fr是所有元素中金属性最强的元素,所以其氧化物对应的水化物碱性极强极强,正确;D.随着原子核外电子层数的增加,碱金属元素的单质的熔沸点逐渐降低,因此其单质的熔点比金属钠的熔点低,正确。
本题难度:简单