|
|
|
高考化学知识点整理《原电池原理》高频试题巩固(2017年最新版)(八)
2017-11-05 23:32:32
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 如图所示装置中,已知电子由b极沿导线流向锌.下列判断正确的是( )
A.该装置中Cu极为阴极
B.一段时间后锌片质量减少
C.b极反应的电极反应式为:H2-2e-+20H-=2H2O
D.当铜极的质量变化为32g时,a极上消耗的O2的体积为5.6L
|
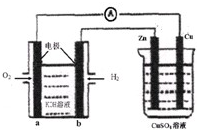
参考答案:A.根据电子流向及燃料电池知,a电极是原电池正极,则铜电极是电解池阳极,故A错误;
B.根据电子流向及燃料电池知,b电极是原电池负极,则锌电极是电解池阴极,阴极上铜离子得电子析出铜,所以锌电极质量增加,故B错误;
C.b电极上氢气失电子和氢氧根离子反应生成水,所以其电极反应式为:H2-2e-+20H-=2H2O,故C正确;
D.根据转移电子守恒知,当铜极的质量变化为32g时,a极上消耗的O2的物质的量=32g64g/mol×24=0.25mol,因为温度和压强未知,无法判断压强的体积,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 燃料电池是燃料(例如CO,H2,CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质通常是KOH溶液。下列关于甲烷燃料电池的说法不正确的是
A.负极反应式为CH4+10OH--8e=CO32-+7H2O
B.正极反应式为O2+2H2O+4e=4OH-
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
参考答案:C
本题解析:甲烷燃料电池的电池反应的离子方程式为CH4+2O2+2OH-=CO32-+3H2O,根据总方程式判断,甲烷燃料电池需消耗氢氧根离子,故溶液碱性减弱,故C错误;故选C。
本题难度:一般
3、选择题 现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,B上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸中,C上发生还原反应;③把B、D用导线连接后同时浸入稀硫酸中,电子流动方向为:B→导线→D,则下列关于金属活动由强到弱顺序正确的是
A.B>A>C>D B.A>B>D>C C.A>B>C>D D.B>A>D>C
参考答案:B
本题解析:在原电池中,负极金属的活泼性一般强于正极金属的活泼性,根据原电池的工作原理判断电池的正负极,进而可以判断金属的活泼性强弱关系。
①A、B用导线相连后,同时浸入稀硫酸中,B上有气泡产生,说明A是负极,B是正极,所以活泼性:A>B;②把C、D用导线连接后同时浸入稀硫酸中,C上发生还原反应,说明C是正极,D是负极,则金属性是D>C;③把B、D用导线连接后同时浸入稀硫酸中,电子流动方向为:B→导线→D,这说明B是负极,D中正极,则金属性是B>D,综上可知金属活泼性顺序是:A>B>D>C,答案选B。
考点:考查根据原电池中电极及反应现象判断金属的活泼性
点评:该题是中等难度的试题,试题针对性强,难易适中,有利于调动学生的学习兴趣和学习积极性。明确原电池的工作原理,特别是电极名称的判断,然后依据原电池中反应现象判断金属的活泼性是解题的关键。
本题难度:一般
4、选择题 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。)
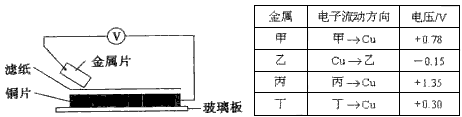
|
|
依据记录数据判断,下列结论中正确的是
[? ]
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
参考答案:B
本题解析:
本题难度:一般
5、选择题 ①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③ ④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是
A? ①③②④? B? ①③④②?
C? ③ ④ ②①?D? ③ ① ②④?
参考答案:B
本题解析:电流从正极流向负极,而负极活泼,则金属活泼性①>②;同理,①>③;H2在正极放出,则④>②;质量减少的一极为负极,则③>④。综上可推得,金属活泼性顺序为①③④②,B项正确。
【考点定位】原电池原理
本题难度:一般
