1、选择题 已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是
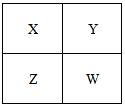
A.Z元素的原子半径可能比Y元素的小
B.W的原子序数可能是Y的原子序数的2倍
C.W的气态氢化物的稳定性一定比Y的强
D.Z的化学活泼性一定比X强
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (每空1分,共9分)A、B、C、D四种元素的最高正价依次为1、4、5、7,其核电荷数按B、C、D、A的次序增大;已知B原子的次外层电子数为2,C、D、A原子的次外层电子数均为8;A原子核外电子总数不超过20。试回答:
(1)各元素符号为:A_____B_____C_____D_____
(2)写出B、D最高价氧化物对应水化物的分子式: _?__、____,并比较其酸性强弱:_________
(3)写出分子BD4的电子式:?
(4)用电子式表示AD的形成过程:??
参考答案:(1)K、C、P、Cl (2)H2CO3? HClO4? HClO4>H2CO3
(3)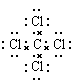 ?(4)
?(4)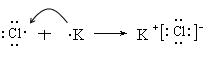
本题解析:考查原子核外电子的排布规律及元素周期律的应用。
A、B、C、D四种元素的最高正价依次为1、4、5、7,则A、B、C、D四种元素分别属于第IA、ⅣA、ⅤA、ⅦA。B原子的次外层电子数为2,则B是C。C、D、A原子的次外层电子数均为8, A的原子序数最大,且不超过20,所以A是K,则D是Cl,C是P。非金属性越强,最高价氧化物的水化物的酸性就越强,所以酸性强弱是HClO4>H2CO3。四氯化碳是由极性键形成的共价化合物,电子式为 。氯化钾是离子键形成的离子化合物,其形成过程可表示为
。氯化钾是离子键形成的离子化合物,其形成过程可表示为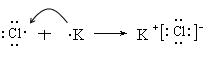 。
。
本题难度:一般
3、选择题 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等。下列说法错误的是( )
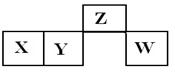
A.Z的氧化物与W的氧化物的化学键类型相同
B.X、Z的氧化物都能溶于氢氧化钠和稀硫酸溶液中
C.最高价氧化物对应水化物稀溶液的氧化性:W<Z
D.Y原子的半径比W原子的半径大
参考答案:B
本题解析:由题意推断出:X为铝,Y为硅,Z为氮,W为硫,A、都是共价键,正确;B、氧化铝是两性氧化物,可以,氮的氧化物是酸性氧化物与稀硫酸不反应,错误;C、稀硝酸的氧化性大于稀硫酸,正确;D、硅的原子半径大于硫的原子半径,正确。
本题难度:一般
4、选择题 某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于? (? )
A.第一周期
B.第三周期
C.ⅣA族
D.ⅤA族
参考答案:C
本题解析:略
本题难度:简单
5、填空题 硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等。
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取的。高温下制取纯硅有如下反应(方法1):
①SiO2(s)+2C(s) Si(s)+2CO(g)
Si(s)+2CO(g)
②Si(s)+2Cl2(g) SiCl4(g)?
SiCl4(g)?
③SiCl4(g)+2H2(g) →Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有?种不同能级的电子,最外层的p电子有?种自旋方向。
(2)硅与碳同主族,单质的还原性:碳?硅(填写“同于”、“强于”或“弱于”)。反应①之所以能进行的原因是?。
(3)反应②生成的化合物的电子式为?;该分子为?分子(填写“极性”或“非极性”)。
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L。则:a?b(填写“大于”、“等于”或“小于”)。
(5)在t秒内,反应②中v(SiCl4)=?(用含a、b的代数式表示)。
(6)工业上还可以通过如下反应制取纯硅(方法2):
④Si(粗) +3HCl(g)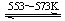 SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0)
⑤SiHCl3(g)+H2(g)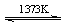 Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:?(选填2条)。
参考答案:(1)5(1分) ,1(1分)
(2)弱于(1分)?因为生成物CO为气态,降低CO的浓度,可使平衡正向移动。(1分)
(3)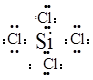 ?(2分)?非极性(1分)
?(2分)?非极性(1分)
(4)小于(1分)
(5)(2a-b)/2t? mol/(L·s) (2分,代数式1分,单位1分)
(6)降低压强;升高温度;及时分离出HCl等(2分)(每条1分,合理给分,共2分。)
本题解析:(1)硅原子核外电子排布式为1S22S22P63S23P2,共有5种不同能级的电子,最外层的p电子有自旋方向要相同所以只有1种自旋方向。
(2)硅与碳同主族,单质的还原性与元素的非金属性变化一致,故碳强于硅。反应①之所以能进行的原因是因为生成物CO为气态,降低CO的浓度,可使平衡正向移动。
(3)反应②生成的化合物是四氯化硅其电子式要保证每个原子达到8电子结构;该分子为是正四面体结构正负电核重心重全,故为非极性分子。
(4)反应②? Si(s)+2Cl2(g) SiCl4(g)?在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,相当于加压,若平衡不移动,此时Cl2的浓度为2a mol/L,实际平衡右移了,t秒后重新达到平衡,Cl2的浓度必小于2a mol/L,但肯定大于a mol/L,b mol/L。故则:a小于b。
SiCl4(g)?在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,相当于加压,若平衡不移动,此时Cl2的浓度为2a mol/L,实际平衡右移了,t秒后重新达到平衡,Cl2的浓度必小于2a mol/L,但肯定大于a mol/L,b mol/L。故则:a小于b。
(5)根据速率的定义可求得在t秒内,反应②中v(SiCl4) =(2a-b)/2t? mol/(L·s) 。
(6)⑤ SiHCl3(g)+H2(g) Si(纯)+3HCl(g)要提高反应⑤中Si(纯)的产率,需要满足尽可能使平衡右移,可采取的措施有:降低压强;升高温度;及时分离出HCl等。
Si(纯)+3HCl(g)要提高反应⑤中Si(纯)的产率,需要满足尽可能使平衡右移,可采取的措施有:降低压强;升高温度;及时分离出HCl等。
本题难度:一般