1、选择题 下列各组比较不正确的是 (?)
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故
C.容沸点:Li>Na>K
D.原子半径:Li<Na<K
参考答案:B
本题解析:K非常的活泼,可以和水反应,故把K放入NaCl溶液中,会立即与水反应,而不会置换出金属钠,故B错误。
本题难度:简单
2、选择题 4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
A.与W相邻的同主族元素可制成重要的半导体材料
B.元素原子半径从大到小的顺序是X、Y、Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素对应的氢化物稳定性最强的是H2Y
参考答案:D
本题解析:根据题意可得:W是C;X是Mg; Y是S;Z是Cl。A.与C元素相邻的同主族元素Si可制成重要的半导体材料。正确。B.元素Mg、S、Cl是同一周期的元素,原子序数越大,原子半径就越小。因此原子半径从大到小的顺序是Mg、S、Cl.正确。C.在CCl4分子中C、Cl原子通过共价键结合且最外层均达到8电子结构。正确。D.C、S、Cl三种元素中非金属性最强的是Cl元素。元素的非金属性越强,其对应的氢化物稳定性就越强,所以稳定性最强的是HCl.错误。
本题难度:一般
3、选择题 氢元素与其他元素形成的化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含中子数为8
B.NH3的结构式为
C.HCl的电子式为 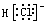
D.沸点: HF> H2O >NH3
参考答案:B
本题解析:D原子含有1个中子,所以一个D2O分子所含中子数为10,A不正确。氯化氢是共价化合物,电子式为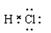 。D中都含有氢键,但沸点最高的是水,其次是氟化氢,D不正确。答案选B。
。D中都含有氢键,但沸点最高的是水,其次是氟化氢,D不正确。答案选B。
本题难度:一般
4、填空题 16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图?;
F元素氧化物的晶体类型为?。
(2)比较B、C、D元素简单离子半径的大小:?>?>?(填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因:?;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式:?,该阳离
子中存在的化学键有?,并写出该阳离子与F氢化物的水溶
液反应的离子方程式:?。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应 ,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为?mol·L-1。?
参考答案:
(1)D离子的结构示意图 ? F元素氧化物的晶体类型为分子晶体
? F元素氧化物的晶体类型为分子晶体
(2)N3->O2->Na+
(3)O的非金属性比S强
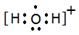 ,化学键有共价键?2H2O+ + H2S =" S" + 2H2O?+ 2H+
,化学键有共价键?2H2O+ + H2S =" S" + 2H2O?+ 2H+
(4)5.6*10-10mol·L-1。
本题解析:略
本题难度:一般
5、选择题 下列物质的成分或主要成分相同的是
A.金刚石和石墨
B.冰和干冰
C.小苏打和烧碱
D.钢铁和煤
参考答案:A
本题解析:A项两物质化学成分为碳;B项干冰的化学成分为二氧化碳;C项小苏打的化学成分为NaHCO3,烧碱为NaOH;D项钢铁是铁的合金,煤是有机物和无机物的混合物.
本题难度:一般